0. 多模态大模型在个性化医学影像诊断的机遇与难题综述
1. 引言
医学影像诊断作为现代医疗体系的核心组成部分,对疾病的早期发现、精确诊断及治疗方案的制定至关重要。然而,
当前医学影像诊断正面临数据量爆炸式增长带来的信息过载和诊断效率瓶颈等严峻挑战 。随着CT、MRI和内窥镜等成像技术的普及,医学影像数据呈指数级增长,加剧了放射科医生面临的信息处理压力。这种海量数据的涌入,包括分子影像、基因组学和可穿戴设备数据,使得现有流程和技术难以有效管理和解释,从而导致诊断效率低下,并可能引发高达4%的临床显著诊断错误 。此外,复杂和非典型病例的诊断难度进一步凸显了传统诊断方法的局限性 。
在此背景下,人工智能(AI)的引入成为提升医学影像诊断能力、应对上述挑战的必然选择。AI在医疗健康领域展现出显著的变革潜力,尤其在改善临床工作流程和患者护理方面。它能够增强诊断、实现个性化医疗并提高手术精度 。AI在医学影像诊断中展现出巨大潜力,能够比传统方法更高效、更准确地解释医疗数据,包括X射线、MRI和CT扫描,尤其在早期发现癌症、心血管疾病和神经系统疾病方面表现突出 。AI的引入旨在解决信息过载、诊断效率瓶颈以及复杂、非典型病例诊断的挑战 。AI在医学影像中的作用正从辅助常规任务扩展到疾病检测、图像解释和患者预后预测等关键领域,将极大提升放射科医生的能力,使其能专注于更复杂的病例和创新性问题解决,而非取代其专业角色 。放射学界对AI工具的经验积累已基本消除了早期担忧,AI被视为机器与人类之间“智能连接”的促进者,其目标是辅助而非取代人类智能 。AI工具已成为医学影像领域不可或缺的一部分,能够提升诊断准确性、优化工作流程并改善图像质量 。
然而,尽管传统AI在医学影像诊断中取得了显著进展,但其在克服单一模态诊断局限性方面仍显不足。当前的医疗AI模型大多受限于单模态输入,未能充分捕捉临床实践的多模态特性,且过度依赖需要大量标注数据进行监督学习,导致模型在特定任务上表现优异但缺乏广泛适用性 。这与医生在现实临床中依赖多种数据源(如影像、病理报告、临床症状、基因组数据等)形成对患者健康的整体视图的实践形成对比 。传统AI在处理复杂异构数据方面的能力不足,限制了其在精准医疗背景下的应用。
为了弥补这一差距并充分发挥AI在医疗领域的潜力,开发能够处理多模态输入,并从大量未标注数据或自然配对数据(如医学图像及其报告)中学习的AI模型变得尤为重要 。多模态人工智能(MM-AI)模型,特别是多模态基础模型(MMFMs)的兴起,预示着AI驱动的医疗创新新时代的到来,它们有望通过整合多样化数据源,变革疾病诊断和治疗路径 。
然而,AI在医疗系统整合中的快速发展也带来了一系列显著的伦理和法律挑战。这些挑战包括患者隐私保护、算法偏见、责任归属、数据处理的复杂性、监管批准、知识产权以及跨境法规等 。尽管多模态基础模型在医疗领域仍处于初期阶段,但在准确性、安全性以及工作流程集成方面仍面临挑战 。因此,推动AI的负责任发展,深入探讨和解决这些伦理与法律问题,是确保AI在医疗领域安全、公平、有效应用的关键。
1.1 个性化医学影像诊断:背景、挑战与AI引入的必然性
医学影像诊断在现代医疗体系中占据核心地位,为疾病的早期检测、精确诊断和治疗方案制定提供关键依据。然而,当前医学影像诊断正面临一系列日益严峻的挑战。随着CT、MRI和内窥镜等成像技术的发展,医学影像数据呈指数级增长,导致放射科医生面临着巨大的信息过载压力。这种海量数据的涌入,包括分子影像、基因组学和可穿戴设备数据等,使得现有流程和技术难以有效管理和解释,进而导致诊断效率瓶颈,并可能出现高达4%的临床显著诊断错误。此外,复杂和非典型病例的诊断难度进一步加剧了传统诊断方法的局限性。
在此背景下,人工智能(AI)的引入成为提升医学影像诊断能力、应对上述挑战的必然选择。AI在医疗健康领域展现出显著的变革潜力,尤其在改善临床工作流程和患者护理方面。它能够增强诊断、实现个性化医疗并提高手术精度。AI在医学影像诊断中展现出巨大潜力,能够比传统方法更高效、更准确地解释医疗数据,包括X射线、MRI和CT扫描,尤其在早期发现癌症、心血管疾病和神经系统疾病方面表现突出。AI的引入旨在解决信息过载、诊断效率瓶颈以及复杂、非典型病例诊断的挑战。AI在医学影像中的作用正从辅助常规任务扩展到疾病检测、图像解释和患者预后预测等关键领域,将极大提升放射科医生的能力,使其能专注于更复杂的病例和创新性问题解决,而非取代其专业角色。放射学界对AI工具的经验积累已基本消除了早期担忧,AI被视为机器与人类之间“智能连接”的促进者,其目标是辅助而非取代人类智能。AI工具已成为医学影像领域不可或缺的一部分,能够提升诊断准确性、优化工作流程并改善图像质量。
尽管传统AI在医学影像诊断中取得了显著进展,但其在克服单一模态诊断局限性方面仍显不足。当前的医疗AI模型大多受限于单模态输入,未能充分捕捉临床实践的多模态特性,且过度依赖需要大量标注数据进行监督学习,导致模型在特定任务上表现优异但缺乏广泛适用性。这与医生在现实临床中依赖多种数据源(如影像、病理报告、临床症状、基因组数据等)形成对患者健康的整体视图的实践形成对比。传统AI在处理复杂异构数据方面的能力不足,限制了其在精准医疗背景下的应用。
为了弥补这一差距并充分发挥AI在医疗领域的潜力,开发能够处理多模态输入,并从大量未标注数据或自然配对数据(如医学图像及其报告)中学习的AI模型变得尤为重要。多模态人工智能(MM-AI)模型,特别是多模态基础模型(MMFMs)的兴起,预示着AI驱动的医疗创新新时代的到来,它们有望通过整合多样化数据源,变革疾病诊断和治疗路径。
然而,AI在医疗系统整合中的快速发展也带来了一系列显著的伦理和法律挑战。这些挑战包括患者隐私保护、算法偏见、责任归属、数据处理的复杂性、监管批准、知识产权以及跨境法规等。尽管多模态基础模型在医疗领域仍处于初期阶段,但在准确性、安全性以及工作流程集成方面仍面临挑战。因此,推动AI的负责任发展,深入探讨和解决这些伦理与法律问题,是确保AI在医疗领域安全、公平、有效应用的关键。
1.2 多模态基础模型(MMFMs):核心概念、技术原理与演进
多模态基础模型(MMFMs)代表了人工智能领域的一项关键进展,其核心概念在于能够整合并处理多种类型的数据,例如医学影像、文本病理报告以及基因组信息等,从而超越了传统单一模态AI模型的局限性。这种多模态处理能力使MMFMs能够从不同数据源中提取互补信息,进而提升诊断的全面性与准确性。相较于传统AI在单一模态数据处理(如高精度图像识别和分割)方面的显著优势,MMFMs能够有效克服其在整合异构信息、实现跨模态理解与生成以及进行复杂临床推理方面的不足。
MMFMs在AI伦理挑战的缓解中展现出独特价值。通过整合多样化的输入,多模态系统能够有效减少对狭窄或偏斜数据集的依赖,从而在一定程度上缓解偏见、提升透明度和问责制。例如,在内容审核或招聘工具中,仅处理文本的模型可能无法准确理解讽刺,但结合视觉或音频线索则能显著提高上下文理解能力,从而降低有害输出的风险,这对于确保公平性至关重要。在医疗健康领域,多模态AI同样面临偏见、可解释性、数据泄露、隐私保护学习、泛化性以及专家知识驱动AI等伦理议题,这些均是MMFMs发展中亟待解决的关键挑战。
大型语言模型(LLMs)作为MMFMs的文本模态核心,在医学领域的发展历程与技术原理值得深入探讨。LLMs的起源可追溯至20世纪50年代,自2017年Transformer网络架构的引入标志着NLP领域的重大转折点,随后GPT和BERT的发布开创了LLMs时代。LLMs的特点在于其庞大的规模和涌现能力,通过在海量数据上进行自监督学习,能够执行多种任务,并在未经明确训练的任务上表现出零样本学习能力。
比较对LLMs在医学诊断中应用的综述,可以发现它们在应用场景、技术侧重点及伦理挑战方面存在共通点与差异。两者均强调了LLMs在医学文本信息处理中的重要性,如报告生成与理解、知识问答和鉴别诊断。详细阐述了LLMs的技术演进,从统计语言模型到神经语言模型再到预训练语言模型(PLMs),并深入剖析了基于Transformer架构的自注意力机制和多头注意力层的工作原理。该文还提及了LLMs在放射学领域的应用,包括报告自动化、信息提取等,并指出了其在生成“幻觉”和事实错误等方面的局限性。相比之下,则更聚焦于LLMs在医学诊断研究中的主导地位,如GPT-4及其变体,并介绍了通过Prompt Tuning、Fine-tuning或从头预训练等方法优化的特定医学领域LLMs(如Med-PaLM 2、BioGPT、ChatDoctor、AcupunctureGPT)。该文还明确指出,未来研究应包括将文本、影像和结构化临床数据整合到统一的多模态框架中,并开发跨模态对齐技术。在伦理挑战方面,两篇综述均提及了LLMs可能存在的风险,如信息不准确和偏见,强调了谨慎使用的必要性。
MMFMs通过融合不同模态数据来增强医学影像诊断的能力。均强调了MMFMs在处理图像、文本、病理报告等多种数据方面的独特优势。MMFMs的开发通常包括预训练和微调两个阶段,其中预训练阶段采用自监督策略,利用大量未标注或自然配对的数据学习通用表示。常见的自监督预训练策略包括对比学习(如CLIP模型)、自预测、生成式模型(如GANs和扩散模型)以及生成式视觉-语言模型(VLM)。许多研究通过结合多种预训练方法来提升性能,例如CoCa模型融合了生成式预训练和对比学习,以更全面地理解图像和文本关系。尽管多模态成像技术结合了CT、MRI和患者病史等信息,并通过AI有效整合,能够提供单一测试无法实现的洞察力,例如将影像数据与基因组信息结合以预测患者对特定治疗的反应,但MMFMs作为下一代AI模型,其优势在于超越传统AI在多模态理解和生成方面的能力,从而实现真正个性化的诊断和复杂的临床推理。
综上所述,AI在放射学中的演进经历了从早期基于规则的系统,到机器学习和深度学习(如CNNs、RNNs、GANs)的兴起,这些传统方法在单一模态数据处理方面展现出显著优势。然而,它们在处理多模态数据时,如难以有效整合影像、文本、基因组等异构信息,以及缺乏跨模态理解和生成能力方面存在局限性,从而无法充分满足个性化诊断和复杂临床推理的需求。MMFMs的出现正是为了解决这些挑战,通过融合多样化的数据模态,为医学影像诊断带来了前所未有的机遇。
1.3 综述目的与结构
本综述旨在全面探讨多模态大模型在个性化医学影像诊断中的机遇与挑战。鉴于人工智能(AI)在医疗健康领域的迅速发展,特别是大型语言模型(LLMs)和多模态基础模型(MFMs)在医学影像诊断中的应用,本研究将系统地梳理现有文献,旨在为研究人员、临床医生、政策制定者和数据集策展人提供全面的洞察和可行的未来策略。
本综述将围绕以下几个核心目的展开:首先,确立并统一AI与医疗健康交叉领域的重要术语,特别是多模态自监督学习(SSL)训练,以构建清晰的学术语境。其次,对医学影像应用中的多模态基础模型进行系统性回顾,提取关键见解并评估其当前发展状态,特别关注涉及放射学图像和病理切片等医学影像的多模态性,因为这些影像在诊断和治疗流程中具有核心作用。第三,本研究将探讨大型语言模型在医学诊断,尤其是放射学领域中的应用现状、评估方法、当前表现以及在不同医学领域的应用情况。
此外,本综述将重点阐述AI在医疗健康领域应用所面临的伦理和法律考量。这包括突出自主性、受益性、无伤害性、公平性、透明度和问责制等关键伦理原则在AI驱动决策中的相关性。同时,本研究将深入探讨数据隐私与安全、AI错误责任、监管审批流程、知识产权和跨境法规等法律挑战,并提出可行的框架和指南,以促进多学科合作和公众参与,从而确保AI的负责任整合与安全公平应用。本综述的独特之处在于其全球视角,对不同司法管辖区的监管方法进行比较分析,并探讨AI在临床决策中日益增长的自主性所带来的长期影响。
本综述的结构将遵循系统性的方法,例如采用PRISMA指南对多模态基础模型在医学影像应用方面的最新贡献进行系统收集和整合,以提供现有情况的全面快照。通过整合传统AI在医学影像应用中的作用,例如图像分割、计算机辅助诊断、预测分析和工作流程优化,本综述将全面评估多模态大模型在个性化医学影像诊断中的机遇与挑战,并展望其未来发展方向。
2. 多模态基础模型在个性化医学影像诊断中的应用机遇
多模态基础模型(MMFMs)在个性化医学影像诊断领域展现出前所未有的机遇,其核心优势在于能够融合并分析来自不同模态的数据,从而克服传统单一模态诊断的局限性。随着人工智能(AI)技术的飞速发展,特别是大语言模型(LLMs)和视觉-语言模型的引入,医学影像诊断的准确性和效率得到了显著提升,同时为精准诊断、个性化治疗支持以及辅助临床决策与知识获取开辟了新的途径。
多模态基础模型能够将医学影像(如CT、MRI)、电子健康记录(EHRs)、病理报告乃至基因组信息等多种模态数据进行深度整合,从而为诊断提供更为全面和互补的依据。这种多模态融合在复杂或非典型病例中尤为重要,因为它能揭示单一模态数据无法捕捉的细微异常和相互关联,进而大幅提高诊断准确率。例如,人工智能在肿瘤学领域的早期检测中已展现出巨大潜力,能够识别肉眼难以察觉的微小病变,显著提升患者生存率。
多模态自监督预训练已被证实能够显著提升下游任务的性能,相较于单模态预训练,其性能增益可高达439%。具体数据显示,结合图像与非图像数据的对比学习模型在曲线下面积(AUROC)上平均提升0.050,准确率提升0.201,F1-score提升0.103;自预测模型在准确率上提升0.147,AUROC提升0.075。这些实证数据充分证明了多模态方法在提升诊断性能方面的优越性,并在阿尔茨海默病诊断和脑肿瘤分割等任务中展现了显著效果。
多模态基础模型不仅能提升诊断准确性,还能显著优化医疗工作流程。通过分析放射学报告中的描述性文本并与影像特征相结合,多模态基础模型能自动提取关键信息,形成更全面的诊断结论。例如,大语言模型在放射科的应用远不止于诊断辅助,还能在患者分流和工作流程优化方面发挥作用,通过自动确定影像检查和协议来优先处理紧急病例,从而简化流程并确保危急病例得到及时关注。此外,大语言模型在生成放射报告的印象和摘要方面的表现也令人鼓舞,能够兼顾连贯性、全面性、事实一致性和潜在危害性。这些能力使多模态基础模型成为放射科医生的AI驱动助手,协助他们解释医学图像并提供初步评估,从而减轻医疗专业人员的工作负担并提供一致的解释,尤其是在偏远或服务不足的地区。
此外,多模态人工智能通过跨模态交叉验证数据,显著提升了决策透明度和可审计性,增强了系统信任度。一个能够同时分析医疗笔记和X射线图像的AI系统,可以通过突出文本症状与视觉异常之间的相关性来解释其诊断结果,这种双重验证机制有助于开发者识别单个模态中存在的错误或偏见,进而提升AI系统的可靠性和可解释性,这对于医疗等需要高度信任的领域至关重要。
2.1 提升诊断准确性与效率
多模态大模型(MMFMs)通过整合不同模态数据,显著克服了单一模态诊断的局限性,从而在医学影像诊断中展现出提升准确性和效率的巨大潜力。传统的医学影像分析主要依赖单一模态数据,而MMFMs能够融合医学影像(如CT、MRI)、电子健康记录(EHRs)中的临床数据、病理报告乃至基因组信息,形成更为全面的诊断依据。这种多模态融合尤其在复杂或非典型病例中表现出更高价值,因为它能够提供传统单一模态无法获得的互补信息,从而提升诊断准确率。
人工智能(AI)在医疗影像诊断中已驱动显著进展,通过快速准确地解读影像,能够识别肉眼难以察觉的细微异常,尤其在肿瘤学等领域,早期检测能大幅提升生存率。AI工具能够从多样化数据集中学习并持续优化模型,使其更可靠和精确。MMFMs在文本理解和生成以及多模态融合方面具有独特优势,进一步增强了AI在医学影像中的作用。例如,大语言模型(LLMs)在处理海量医学数据方面展现出巨大潜力,包括分子影像、基因组学和可穿戴设备数据,而当前技术和流程难以有效处理这些信息。LLMs能够处理和分析大量文本数据,如从电子健康记录中识别和分类疾病,甚至能有效处理非英语医疗文档。在影像数据分类方面,随着视觉-语言模型的引入,LLMs展现出强大的表征学习能力,能够理解、生成和处理各种图像数据类型,例如在皮肤病学中辅助早期检测黑色素瘤,在放射学领域解释X光和MRI等专业医学图像,识别异常并辅助诊断。
多模态模型在特定疾病诊断中的性能提升已得到具体数据的支持。一项系统综述发现,与单模态预训练相比,多模态自监督预训练通常能提高下游任务的性能,增益范围可达439%。在结合图像与非图像数据的研究中,对比学习模型在AUROC(受试者工作特征曲线下面积)上平均提升0.050,准确率提升0.201,F1-score提升0.103。自预测模型在准确率上提升0.147,AUROC提升0.075。这些数据强有力地证明了多模态方法在提升诊断性能方面的优越性。此外,多模态自监督学习在图像-图像模态间的应用也显示出对阿尔茨海默病诊断和脑肿瘤分割的有效性。
MMFMs能够通过分析放射学报告中的描述性文本,自动提取关键信息(如病灶大小、位置、性质),并与影像特征相结合,形成更全面的诊断结论。例如,LLMs在放射科中的应用不仅限于诊断辅助,还能在患者分流和工作流程优化方面发挥作用,通过自动确定影像检查和协议来优先处理紧急病例,从而简化工作流程并确保危急病例得到及时关注。此外,LLMs在从放射报告中生成印象和摘要方面的表现也令人鼓舞,考虑了连贯性、全面性、事实一致性和危害性。这些能力使得MMFMs能够作为放射科医生的AI驱动助手,协助他们解释医学图像并提供初步评估,从而减轻医疗专业人员的工作负担并提供一致的解释,尤其是在偏远或服务不足的地区。
多模态AI的另一重要贡献是其通过跨模态交叉验证数据来提升决策透明度和可审计性,从而增强系统信任度。例如,一个同时分析医疗笔记和X射线图像的AI系统可以通过突出文本症状与视觉异常之间的相关性来解释其诊断结果。这种双重验证有助于开发者识别单个模态中存在的错误或偏见,进而提升AI系统的可靠性和可解释性,这对于医疗等需要高度信任的领域至关重要。
2.2 实现精准诊断与个性化治疗支持
多模态基础模型(MMFMs)在实现精准医疗方面展现出巨大的潜力,通过整合患者特异性的多模态数据,提供定制化的诊断和治疗支持方案。这些模型能够整合多种独特模态,如基因数据、临床数据、ICD代码、语音以及患者体型档案,从而为模型提供更全面的患者视图,显著提高诊断和预后能力。人工智能通过整合医学影像数据与其他患者指标(如基因组信息、病史),实现了对个体化治疗方案的定制,从而提升治疗效果并降低风险。
MMFMs能够识别个体差异,从而实现更精准的风险评估和预后预测。例如,Taleb 等人的研究结合眼底图像与单核苷酸多态性(SNP)和多基因风险评分,增强了眼底病理检测并促进了与眼底疾病相关的基因识别。Jiao 等人则利用超声图像与临床医生描述的音频数据进行配对,以提升模型性能。Blankemeier 等人训练的CT基础模型Merlin通过预测ICD代码和CT图像与报告的对比学习,在多项任务上取得了最先进的性能,并能处理完整的CT扫描数据。这些研究表明,多模态基础模型通过整合多种组学数据、影像特征和临床表型,为个体患者提供独特的洞察,从而实现更精准的诊断和个性化治疗方案。
在实现精准医疗方面,多模态模型通过整合基因组学数据预测药物反应,或结合病理影像实现肿瘤亚型精准分级,为个性化治疗提供决策支持。MMFMs通过整合患者的个体化多模态数据,包括独特的影像特征、病理报告、基因组信息和临床记录,有望实现更精细、更具针对性的精准诊断和个性化治疗方案。在肿瘤学领域,MMFMs可以分析患者的影像学表现与基因突变信息,预测对特定药物的反应,从而指导医生选择最有效的靶向治疗或免疫疗法。人工智能算法能够根据影像数据评估肿瘤特征,预测患者对特定治疗(如化疗或放疗)的反应,从而优化治疗方案,减少不必要的干预和副作用。在心脏病学中,人工智能分析CT或MRI扫描中的动脉阻塞影像数据,帮助心脏病专家制定个性化的治疗计划。人工智能能够根据患者的基因标记预测其对特定药物的反应,确保“对的治疗方案在对的时间给对的患者”。这种整合多组学数据(如基因组学、蛋白质组学)、影像特征和临床表型的方法,使得模型能够为每位患者提供独特的洞察,而非仅仅基于群体统计的诊断,从而为实现真正的个性化医疗奠定基础。
然而,在个性化医疗中平衡患者隐私与数据需求是一个核心挑战。这需要强调知情同意的核心原则,以及数据匿名化在保护隐私方面的作用及局限性。尽管多模态基础模型在整合多种数据方面具有显著优势,但大多数研究并未明确提及模型在提供精准诊断和个性化治疗方案时如何平衡患者隐私与个性化数据需求、确保知情同意和数据匿名化。现有文献强调需要关注隐私保护学习,以平衡患者隐私与个性化数据需求,确保知情同意和数据匿名化。实现精准诊断与个性化治疗支持离不开对患者隐私的严格保护,这构成了核心的伦理与法律挑战。未来的研究需更深入探讨这些伦理和法律问题,以促进多模态人工智能在医疗领域的安全与公平应用。
2.3 辅助临床决策支持与知识获取
多模态大模型(MMFMs)作为辅助临床决策支持工具,在提升医学影像诊断效率与准确性方面展现出巨大潜力。MMFMs能够通过整合和分析多模态数据,如医学影像、临床语言、基因组学信息,为医生提供全面的诊断建议,从而协助医生进行疾病筛查、鉴别诊断和预后评估。例如,Med-PaLM Multimodal便能通过单一模型权重处理和解释多种生物医学数据。
MMFMs在提供可解释的诊断依据方面具有显著优势,从而提高医生对诊断结果的信任度。它们能够通过生成可解释的报告、关联相似病例以及提供最新研究文献摘要等方式,增强医生的知识获取和推理能力。例如,LLaVA-Rad和MAIRA-2等小型开源视觉-语言模型(VLMs)不仅能够生成报告,还能将报告与图像中的边界框关联,方便医生进行验证。这种可解释性有助于减少误诊,提升诊疗质量,并支持复杂的临床判断。
大语言模型(LLMs)作为MMFMs的重要组成部分,在辅助临床决策和知识获取方面扮演着“智能助手”的角色。LLMs能够处理海量文本数据,如电子健康记录和医学文献,辅助疾病分类和鉴别诊断,尤其在神经退行性疾病的鉴别诊断以及处理非结构化文本以提供潜在诊断方面表现出色,有效减轻了医生和公共卫生部门的负担。在医学问答(QA)方面,LLMs在MedQA数据集上展现出显著提高的准确性,并且ChatDoctor和AcupunctureGPT等针对特定医学任务优化的LLMs通过整合信息检索机制或传统中医原理,提升了医患对话质量和诊断准确性。这些模型能够提供准确可靠的疾病症状、诊断、治疗方案和预防措施等信息,从而增强医生的知识获取和推理能力。
LLMs还能通过自然语言生成技术,为患者提供可理解的诊断报告和健康指导,这有助于优化诊断流程。在急诊医学和放射学等医生短缺的领域,LLMs被用作辅助工具以减轻工作量,例如在急诊患者分级和生成放射学报告方面的快速推理和视觉理解能力。LLMs能够为不同医学专业快速发展专业知识并生成临床问题的答案,通过根据最新发表的论文和特定领域的医学文献微调内容,最终增强临床决策支持、改善患者参与和加速医学研究。例如,PubMedBERT和ClinicalBERT已成功应用于根据患者笔记自动确定食管炎的存在和严重程度,以及通过重症监护病房患者入院24小时内的临床笔记准确预测短期、中期和长期死亡率。
在放射学领域,LLMs在解释影像发现、澄清放射学程序和提供不同类型影像模态的总体信息方面展现出其价值。放射科医生、住院医师甚至患者都可以与这些模型互动以获取相关问题的答案。LLMs还可以作为放射科住院医师的虚拟导师,帮助理解复杂概念、解释图像并提供学习资源,从而促进自主学习和知识保留。此外,LLMs能够与现有放射学软件和系统集成,作为其自然语言界面,例如通过简单的语言查询检索患者数据、报告和图像,或建议结构化报告模板以确保报告的完整性。AI驱动的虚拟助手甚至能够创建初步的放射学报告,显著提高了工作效率,并有助于预防放射科医生的职业倦怠。
然而,尽管MMFMs和LLMs在辅助临床决策中展现出巨大潜力,但仍需强调人机协作在医疗决策中的伦理重要性,确保AI是辅助而非取代医疗专业人员的工具。临床试验数据显示,LLMs主要作为医生在整个诊断过程中的支持工具(70%的试验),而非直接诊断疾病。LLMs在面对临床偏见问题时,其生成的诊断内容可能准确性降低,且在处理真实临床场景中的模糊性和不确定性时面临挑战,这需要LLMs具备深厚的医学知识以及处理复杂、非典型症状的能力。因此,医生仍需对AI提供的建议进行人工验证,以确保医疗决策的准确性和安全性。
3. 多模态基础模型在个性化医学影像诊断中的核心挑战
多模态大模型(Multimodal Large Models, MMLMs)在个性化医学影像诊断领域展现出巨大潜力,通过整合来自不同模态的数据(如医学影像、临床文本、病理切片),有望提供更全面、精准的诊断与治疗建议。然而,在将这些先进技术应用于临床实践的过程中,仍面临一系列核心挑战。这些挑战不仅涵盖技术层面,如数据获取与预处理、模型性能与泛化性,还涉及更为复杂的伦理、法律和社会层面的考量,例如患者隐私保护、责任归属、用户信任以及最终的临床转化与系统集成。
首先,在数据层面,医学数据的异质性、不平衡性及隐私敏感性构成了 MMLMs 训练和部署的基础性难题。不同模态数据在格式、来源、质量和标注规范上的显著差异,要求复杂的标准化和整合流程,若处理不当将直接影响模型效果与泛化能力。此外,特定疾病或罕见病数据集的稀缺性、历史数据固有的偏见以及患者隐私法规的严格限制,使得高质量、大规模、多样化且标注完善的医学数据集难以获取,这严重制约了模型的训练和泛化能力,并可能加剧医疗不公平性。尽管合成数据生成等技术提供了缓解数据稀缺的途径,但去识别化过程中的信息损失和再识别风险依然存在,对模型性能和训练效用构成潜在影响。因此,开发统一的多模态框架、创建反映真实世界复杂性的基准数据集,并倡导患者数据捐赠,是应对这些数据挑战的关键方向。
其次,MMLMs 的应用还引发了复杂的隐私、伦理与法律责任问题。医疗数据固有的敏感性使得隐私保护成为核心关注点,现有法规如 HIPAA 和 GDPR 对数据处理提出严格要求,但如何在 MMLMs 大规模应用中平衡患者隐私与个性化数据需求仍是一大挑战。数据匿名化和去识别化技术面临局限,多模态数据关联性的增强可能导致再识别风险,凸显了联邦学习和差分隐私等更先进隐私保护技术的重要性。更深层次的挑战在于,当 MMLMs 出现误诊或提供错误建议时,责任归属模糊,且模型“黑箱”特性加剧了可解释性和可追溯性的难题。此外,训练数据中存在的历史偏见可能被模型反映并放大,导致诊断结果不公平,加剧医疗不平等现象。模型可能产生的“幻觉”现象进一步凸显了谨慎使用的必要性。因此,建立健全的伦理审查机制、完善法律框架、开发国际偏见审计标准、推广安全的多机构训练基础设施以及引入适应性监管框架,是确保 MMLMs 安全、公平、负责任应用的关键举措。公共信任和参与也是 MMLMs 成功整合医疗领域的基石。
第三,在模型性能与泛化性方面,MMLMs 面临可解释性与透明度不足、训练数据偏差与泛化性受限、模型鲁棒性与对抗性攻击敏感性以及“幻觉”问题,同时评估标准与基准数据集也存在欠缺。深度学习模型的“黑箱”特性使得临床医生难以理解诊断依据,影响对 AI 诊断结果的信任和采纳,尤其是在复杂病例中,人类经验应与 AI 见解互补。虽然 LIME 和 SHAP 等可解释性方法正在探索中,但处理多模态或复杂 MMLMs 时仍存在局限性,例如难以捕捉跨模态交互解释或缺乏对高维特征的直观表示。这要求未来研究开发“推理链”框架,通过可视化 LLM 的诊断路径,明确症状输入与疾病假设的中间证据,以提高可解释性和透明度,从而建立对 AI 诊断结果的信任并增强人机协作的伦理重要性。此外,训练数据偏差(如地域限制、人群代表性不足)导致模型泛化能力受限,在面对未见数据时性能显著下降,甚至产生偏见,导致诊断不准确或不公平。为克服数据偏差,需要确保训练数据集的包容性和多样性,并采用数据增强、联邦学习、领域适应或迁移学习等技术弥补数据不足,提高模型的鲁棒性和公平性。模型在面对噪声数据或对抗性攻击时表现出的脆弱性,以及生成虚构事实的“幻觉”问题,都对患者安全构成威胁。提升模型鲁棒性与减少“幻觉”现象,如通过整合在线搜索功能进行验证、对抗训练和模型校准等方法,是增强模型可靠性的重要方向。最后,现有评估指标在捕捉复杂临床情境下的模型表现方面存在局限性,且普遍缺乏统一的、大规模、高质量的多模态基准数据集,阻碍了不同模型性能的公平比较和技术标准化。因此,未来需要建立更具临床意义且以人为中心的评估标准,并构建标准化、大规模多模态基准数据集,以确保 AI 系统部署后仍能持续监测其公平性。
最后,MMLMs 的临床转化与系统集成面临多重挑战,涵盖技术、用户接受度以及政策和文化等维度。技术集成障碍主要体现在 MMLMs 与现有临床工作流程(如 RIS 和 PACS)的兼容性问题,缺乏标准化的 API 接口、数据传输协议的安全性和效率不足,以及系统间互操作性差等。庞大的模型规模和计算需求也使得医院内部署面临挑战,引发了患者健康记录传输到外部模型提供商时的隐私和安全担忧。用户接受度与信任建立是关键非技术性障碍,医生对 AI “黑箱”模型的不透明性、对潜在误诊风险的担忧以及对现有工作流程改变的抵触心理,均阻碍了 MMLMs 的广泛应用。政策与文化因素也构成广泛障碍,监管框架的碎片化、数据隐私风险、伦理困境以及各地区监管不一致,共同形成了复杂的合规性环境,阻碍了 MMLMs 的全球部署和临床转化。为了克服这些挑战,需要开发以人为中心的人机交互界面,确保 MMLMs 补充而非取代医生的专业知识,并通过教育倡议和开放对话提高公众对 AI 的认识,促进公共信任和参与,从而确保 MMLMs 在医疗领域的成功整合。所有利益相关者(包括模型开发者、临床医生、政策制定者和数据集策展人)的协同努力至关重要。
3.1 数据获取与预处理挑战
| 挑战类别 | 具体挑战 | 描述 | 伦理影响 | 应对策略 |
|---|---|---|---|---|
| 数据异质性 | 格式、来源、质量差异 | 影像、文本、病理等数据格式不同,来源分散,质量参差不齐,标注规范不统一。 | 影响模型训练效果和泛化能力。 | 数据标准化、统一标注规范、开发统一多模态框架。 |
| 数据不平衡/稀缺 | 特定疾病/罕见病数据匮乏 | 高质量、大规模、标注完善的医学数据集难以获取,特别是罕见病或特定人群数据。 | 导致模型在某些群体或疾病上性能下降,加剧医疗不公平性。 | 数据增强、合成数据生成、提倡患者数据捐赠、构建多样化基准数据集。 |
| 历史偏见 | 数据反映历史医疗实践偏差 | 现有数据可能内含过去的医疗待遇不平等,使模型延续偏见。 | 加剧医疗不公平性,导致诊断不准确或不公平。 | 确保训练数据集包容性和多样性、算法审计、公平性约束、跨学科团队设计。 |
| 患者隐私问题 | 严格法规限制数据共享 | HIPAA和GDPR等法规严格限制医疗数据共享,使得数据集规模受限。 | 增加数据泄露风险,限制模型训练规模和泛化能力。 | 隐私保护学习(FL, DP)、同态加密、安全多方计算、数据匿名化、高级别安全措施、利用GANs生成合成数据。 |
| 信息损失/再识别风险 | 去识别化过程中的局限性 | 去识别化可能导致信息损失,且多模态数据关联性增强可能实现再识别。 | 影响模型性能和训练效用,存在数据泄露和再识别风险。 | 严格数据匿名化、访问控制、知情同意、持续关注隐私增强技术。 |
在个性化医学影像诊断中,多模态大模型(Multimodal Large Models, MMLMs)的效能很大程度上取决于高质量、多样化的医学数据。然而,在数据获取与预处理阶段面临诸多固有挑战,尤其是在伦理方面。
首先,医学数据的异质性是显著的障碍。医学影像数据(如CT、MRI、X光)与临床文本报告、病理切片等不同模态数据在格式、来源和质量上存在显著差异。例如,影像数据需要复杂的图像处理和标准化流程,而临床文本则常包含非结构化信息、缩写和专业名词,且标注规范不统一,这些因素均导致数据整合的复杂性。这种异质性若未得到有效处理,将直接影响模型训练效果和泛化能力。
其次,数据不平衡和历史偏见是导致模型在实际临床应用中不可靠性和不公平性的关键因素。特定疾病或罕见病数据集的稀缺性,以及高质量、大规模、标注完善的医学数据集的普遍匮乏,对模型的训练和泛化能力构成显著制约。现有数据可能反映出历史上的医疗实践偏差,导致模型在某些群体或疾病上的性能下降,从而加剧医疗不公平性。大型语言模型(LLMs)在处理医学影像和文本数据时,需要深厚的医学知识和应对模糊性、不确定性的能力,这更强调了高质量和多样化训练数据的重要性。
再者,患者隐私问题对大规模医疗数据的获取构成了重大障碍。隐私保护法规(如HIPAA和GDPR)严格限制了数据共享,使得目前最大规模的公开医疗数据集与通用领域的基础模型训练数据量相比仍相形见绌。尽管生成对抗网络(GANs)等技术通过生成逼真且匿名的合成图像,为缓解数据可用性限制提供了安全有效的训练环境,但去识别化过程中可能导致的信息损失仍然是一个需要关注的问题,可能影响模型在临床应用中的性能和训练效用。此外,数据泄露作为多模态人工智能在医疗健康领域面临的伦理挑战之一,也间接影响了模型训练的泛化能力。
为应对上述挑战,数据标准化和增强方法,以及在数据收集和预处理过程中纳入伦理考量是必不可少的。数据标准化有助于消除不同来源、格式数据的差异,确保输入模型的统一性。数据增强技术如合成数据生成,可在一定程度上缓解数据稀缺问题。同时,必须深入探讨数据量和数据质量之间取得平衡的挑战。虽然训练多模态基础模型需要大量未标注数据以提高模型对分布变化的韧性,并促进涌现特性,但利用公共来源数据,例如PubMed图像、医学教科书或社交媒体帖子,可能无法满足临床应用所需的严格标准。未来模型开发必须权衡大规模数据集的优势与高质量、临床相关信息的需要,以确保人工智能模型在现实医疗应用中既强大又可靠。提高数据可访问性和多样性,提倡普遍的电子影像交换,并建议患者捐赠其去识别化的数据用于研究和人工智能训练,是未来重要的方向。此外,开发能够整合文本、影像和结构化临床数据的统一多模态框架,并创建反映真实世界复杂性的基准数据集(例如具有异步实验室和影像更新的纵向患者记录),对于实现多模态整合至关重要。
3.2 隐私、伦理与法律责任挑战
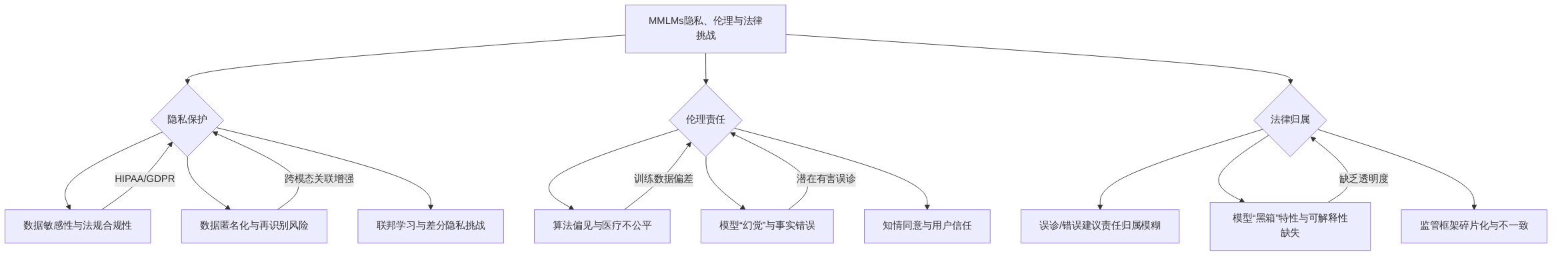
医疗数据固有的敏感性使得隐私保护在个性化医学影像诊断中尤为关键。多模态大模型在数据收集、存储和共享过程中面临显著的安全风险。现有法规框架,如美国《健康保险流通与责任法案》(HIPAA)和欧盟《通用数据保护条例》(GDPR),对医疗数据处理提出了严格的合规性要求。这些法规旨在确保患者数据的机密性和完整性,但在多模态基础模型大规模应用时,仍需平衡患者隐私与个性化数据需求。
在数据隐私保护方面,大型语言模型(LLMs)的伦理考量尤为突出,主要体现在数据匿名化和去识别化的局限性上。尽管去识别化技术能够降低数据泄露风险,但多模态人工智能(AI)结合多种数据类型(如影像、文本、语音)时,数据关联性显著增强,即使部分匿名化也可能通过交叉关联实现再识别。例如,智能助手若同时使用语音和摄像头数据,可能会在无意中泄露敏感信息。这强调了在多模态人工智能系统中实施严格的数据匿名化、访问控制和确保知情同意的重要性。当前数据匿名化和去识别化技术在去识别化过程中可能存在信息损失,并且面临再识别的风险,这促使研究者转向联邦学习和差分隐私等更先进的隐私保护技术。然而,这些技术在大型语言模型训练和部署中仍面临挑战,如计算开销增加和模型性能下降。
多模态基础模型的应用还涉及复杂的伦理和法律责任归属问题。当人工智能系统做出误诊或提供错误治疗建议时,责任应由开发者、医生还是医疗机构承担,目前尚无明确界定。人工智能模型的“黑箱”特性使得其决策过程缺乏透明度和可解释性,增加了潜在的误诊风险和责任认定的复杂性。此外,人工智能决策可能导致社会公平问题,例如算法偏见可能导致不同患者群体在诊断结果和医疗资源分配方面受到不公平对待。大型语言模型尤其容易反映并放大训练数据中存在的偏见,导致诊断建议的偏颇和患者护理差异,如基于种族或性别的偏见,以及对某些群体的过度乐观预后判断。
当前,大型语言模型还存在“幻觉”(即生成虚构事实)和事实错误等局限性,这进一步凸显了谨慎使用的必要性。尽管Med-Gemini等模型通过整合在线搜索功能来验证输出,为增强人工智能辅助医疗决策的可靠性提供了参考,但仍需平衡模型能力、可部署性和安全性。
鉴于上述挑战,建立健全的伦理审查机制和法律框架至关重要。监管框架的碎片化、数据隐私风险和伦理困境,以及各地监管不一致(如美国、欧盟、中国),构成了复杂的合规性环境,阻碍了大型语言模型的全球部署。例如,医疗软件需要一致和可复现的结果,但这与大型语言模型生成差异化内容的特性相悖。为此,需要开发国际偏见审计标准,要求大型语言模型在诊断准确性上展现出更少的人口统计学差异,并通过联邦学习等技术构建安全的多机构训练基础设施,同时遵守《通用数据保护条例》和《健康保险流通与责任法案》等法规。此外,还需提出适应性监管框架,平衡大型语言模型输出的概率性与医疗设备安全要求,并可能引入对高风险诊断的实时临床医生监督协议。目前只有少数试验明确提到了隐私保护措施,表明大型语言模型研究中亟需标准化数据安全措施的报告。公共信任和参与对于人工智能在医疗领域成功应用和整合至关重要。
3.3 模型性能与泛化性挑战
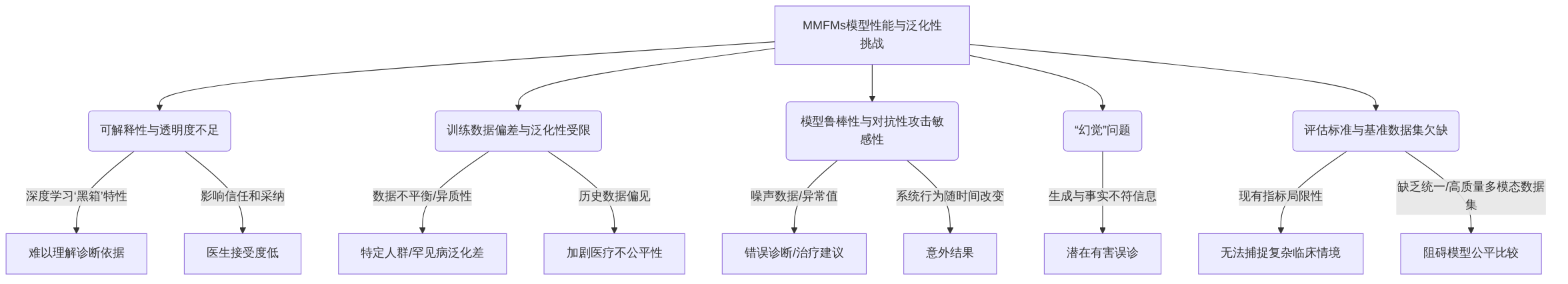
多模态大模型(MMFMs)在个性化医学影像诊断中展现出巨大潜力,但其在模型性能与泛化性方面面临显著挑战。这些挑战主要体现在以下几个方面:模型的可解释性与透明度不足、训练数据偏差与模型泛化性受限、模型鲁棒性与对抗性攻击敏感性以及“幻觉”问题,以及评估标准与基准数据集的欠缺。这些问题不仅限制了 MMFMs 在临床实践中的广泛应用,还对患者安全和医疗公平性构成了潜在威胁,因此亟需深入研究并提出有效的解决方案。
3.3.1 可解释性与透明度挑战
多模态大模型(MMFMs)在个性化医学影像诊断中展现出巨大潜力,但其固有的“黑箱”特性对临床应用构成显著挑战,尤其是在可解释性与透明度方面。这种不透明性源于深度学习模型层级的复杂性和非线性激活函数等技术原因,使得临床医生难以理解诊断依据,从而阻碍了对AI诊断结果的信任和广泛采纳。在诊断或治疗计划等关键领域,患者和医护人员迫切需要理解AI推荐的决策依据,以便做出明智决策,并在必要时对AI的建议进行质疑或调整,尤其是在复杂病例中,临床判断和人类经验应与AI见解互补。
为了应对这些挑战,研究者正在探索不同的可解释性方法,例如局部可解释模型无关解释(LIME)和SHapley加性解释(SHAP),以期在多模态模型中实现应用。然而,当前的可解释性方法在处理多模态或复杂MMFMs时仍存在局限性,例如难以捕捉跨模态的交互解释或缺乏对高维特征的直观表示。例如,尽管MAIRA-2模型通过将生成的报告与边界框关联起来,间接提升了模型的可解释性,但仍需进一步提高MM-LLMs的可解释性,例如通过因果推理和反事实解释,以增强模型在医学应用中的透明度和可靠性。
医生对模型决策透明度的需求日益增长,而多模态系统通过交叉验证不同模态的数据,原则上可以提高决策透明度,使模型产生特定结果的原因更容易被审计。然而,这同时也引入了复杂性,开发者必须确保每种模态的贡献都可追溯,并且不会强化现有的偏见。未来的研究需要开发“推理链”框架,如通过可视化大语言模型(LLM)的诊断路径,明确将症状输入与疾病假设通过中间证据(例如,“C反应蛋白升高感染可能性结核病与淋巴瘤的鉴别权重”)联系起来,以提高模型的可解释性和透明度。这种方法旨在使模型决策过程对临床医生透明,从而建立对AI诊断结果的信任,并增强人机协作在医疗决策中的伦理重要性。此外,开发方法使模型决策过程对临床医生透明,包括生成可视化的注意力图或关键特征,以及提供证据链来支持诊断,对于建立对AI诊断结果的信任至关重要。
3.3.2 数据偏差与模型泛化性挑战
训练数据偏差对多模态基础模型的性能和公平性构成显著负面影响,是多模态人工智能(AI)在医疗领域面临的关键伦理挑战之一。数据不平衡和数据异质性限制了模型在特定人群或罕见疾病上的泛化能力,导致模型在面对未见数据时性能显著下降,甚至可能产生偏见,导致诊断不准确或不公平。
数据偏差的根本原因在于多方面。首先,数据采集存在地域限制、历史数据集的代表性不足,以及特定人群(如少数民族、女性、低收入人群或罕见病患者)数据的缺失。这些不足导致人工智能模型无法准确识别这些群体的疾病或进行准确预测。其次,医学知识和实践中固有的偏见也可能被数据所反映和放大。例如,历史数据可能内含了过去医疗待遇中的不平等,使得人工智能模型在学习过程中延续这些不公平现象。大型语言模型(LLMs)尤其容易反映并放大其训练数据中的历史偏见,可能加剧医疗保健中的现有不平等现象。研究表明,大型语言模型在医学诊断和患者信息处理中会表现出基于种族、性别、年龄、社会地位和收入水平的偏见,例如生成带有偏见的患者背景,将疾病与特定人口群体关联,或在治疗建议中偏袒特定群体,甚至对不同种族群体预测不同的成本、住院时长和预后。这些偏差可能导致患者接受的诊断质量下降,进而对医疗公平性产生负面影响。例如,一项研究发现,一项用于医疗干预风险预测的算法,由于其训练数据侧重于医疗支出而非医疗需求,系统性地对黑人患者造成了不利影响,导致其健康风险被低估,从而加剧了医疗服务和治疗获取的不公平性。
为克服数据偏差,提高模型的鲁棒性和公平性,需采取多项策略。首先,确保训练数据集的包容性和多样性,使其能够代表所有患者群体,包括进行算法审计以识别和纠正模型中的偏见。其次,可以采用数据增强、联邦学习、领域适应或迁移学习等技术来弥补数据不足和提高模型的泛化能力。例如,多模态人工智能通过整合多样化输入,可以减少对狭窄或偏斜数据集的依赖,从而有助于解决偏见问题,改善上下文理解,降低误分类的风险。然而,开发者仍需警惕并确保每种模态的贡献可追溯,且不会强化现有偏见。在算法设计中融入公平性考量也至关重要,例如通过引入公平性约束或优化平等机会等技术来减轻差异影响。此外,通过多样化的跨学科团队设计公平和有代表性的人工智能模型,以及对大型语言模型的偏见表现进行持续监控,也有助于确保其在医学诊断应用中的公平性。尽管提示调优和人类反馈强化学习可以缓解部分偏见,但这通常只提供了“防护罩”,未能从根本上改变模型内部的偏见,且可能增加计算成本或导致诊断结果模糊。因此,未来的研究需探索彻底消除有偏见医学诊断的有效方法。
3.3.3 模型鲁棒性、对抗性与幻觉挑战
多模态大模型(MMFMs)在个性化医学影像诊断中展现出巨大潜力,但其在复杂和不确定环境下的模型鲁棒性、对抗性攻击敏感性以及“幻觉”问题构成了重大挑战。MMFMs在面对噪声数据、异常值或对抗性攻击时表现出的脆弱性,可能导致错误的诊断或治疗建议,从而对患者安全构成威胁。此外,人工智能(AI)系统自我学习能力可能导致其行为随时间改变,产生未经初始部署或批准时未考虑到的意外结果,这需要持续监控和强大的验证机制来确保模型的鲁棒性和安全性。
“幻觉”问题是MMFMs在医学领域中面临的突出挑战之一,即模型生成与事实不符的信息,这在医疗环境中可能导致潜在的有害误诊。虽然现有文献主要关注大语言模型(LLMs)的“幻觉”现象,但这一问题同样适用于MMFMs,其可能导致错误的诊断或治疗建议,对患者安全构成威胁。“幻觉”的产生机制可能源于训练数据中的噪声、模型在生成过程中过度自信,或缺乏对事实的强约束力。例如,LLMs在处理非结构化输入(如“胸痛”的模糊性)时,需要生成合理的鉴别诊断,但其有限的上下文窗口可能导致关键信息丢失,从而间接反映出鲁棒性不足的问题,并可能加剧“幻觉”现象。
模型鲁棒性与对抗性攻击是MMFMs在医学应用中面临的另一关键挑战。AI模型在面对噪声数据、异常值或对抗性攻击时表现出脆弱性,这些攻击可能导致错误的诊断或治疗建议,对患者安全构成威胁。尽管文章并未深入探讨对抗性攻击的具体技术细节或解决方案,但普遍认为,对抗性攻击可能通过文本扰动或梯度攻击等方式,对诊断结果产生潜在影响。例如,自主学习能力带来的风险演变,使得系统行为可能随时间变化,产生在初始部署或批准时未预料到的意外结果,这强调了持续监控、强大的验证机制和适应性监管框架的必要性。
为提升MMFMs的安全性与诊断可靠性,未来研究应致力于提高其鲁棒性与减少“幻觉”现象。Med-Gemini等模型通过整合在线搜索功能来验证其输出,为增强AI辅助医疗决策的可靠性和安全性树立了宝贵的先例。这表明了在处理“幻觉”现象时需要采取的策略。提高MMFMs的可解释性和鲁棒性,例如通过对抗训练、模型校准等方法,是增强模型在医学应用中透明度和可靠性的重要方向。此外,通过强化学习、知识蒸馏或多模型集成等方法,并结合持续监控机制,可以进一步提升模型的安全性,保障诊断的可靠性。
3.3.4 评估标准与基准数据集挑战
当前多模态大模型(MMFMs)在个性化医学影像诊断领域的评估面临诸多挑战,尤其是在伦理与公平性方面存在显著不足。现有评估指标主要关注诊断准确性、疾病分类和生成诊断内容的质量,例如医学问答(QA)的准确性。然而,这些指标在捕捉复杂临床情境下的模型表现方面存在局限性,未能充分反映人工智能(AI)对患者真实世界的影响。
具体而言,现有评估方法难以处理真实临床环境中非结构化输入的模糊性、不确定性、动态交互和实时反馈的需求。例如,大型语言模型(LLMs)的有限上下文窗口(如GPT-4的32,000个token)可能导致关键医疗信息丢失,且动态合成实验室结果、影像报告及其他多模态数据对于准确合理的诊断至关重要,但LLMs的跨模态对齐技术仍不成熟。这凸显了在评估中结合专家知识的必要性,以应对现实临床环境的复杂性。
此外,现有评估标准在放射学报告生成等具体任务中也暴露出其局限性。常用的基于词汇相似度指标(如BLEU、ROUGE)和事实准确性指标(如F1-CheXpert、F1-RadGraph)被发现与放射科医生进行的手动错误评分(更具临床实用性)相关性有限。尽管有研究尝试引入新的评估方法,如LLaVA-Rad使用GPT-4自动分析生成报告错误类型,并生成与人类评估无统计学差异的CheXpromt指标,但这仍旧强调了当前评估标准的不足。
除了评估指标的局限性,当前还普遍缺乏统一的、大规模、高质量的多模态基准数据集。这使得不同模型性能的公平比较难以实现,严重阻碍了研究进展和技术标准化,以及人工智能在医疗影像领域的临床转化。数据的无缝集成和系统互操作性也被认为是实现人工智能全部潜力的关键挑战之一。
为解决上述挑战,未来需要建立更具临床意义且以人为中心的评估标准,并构建标准化、大规模多模态基准数据集,以确保人工智能系统部署后仍能持续监测其公平性。新的评估指标不仅应关注技术性能,更应反映人工智能在临床决策链中的实际价值和医生使用体验,例如引入医生的决策时间缩短、诊断信心提升和诊断错误率等指标。此外,未来的研究应创建能够反映真实世界复杂性的基准数据集,并进行大规模前瞻性试验以比较LLM辅助诊断与传统诊断流程,评估其长期临床影响。
3.4 临床转化与系统集成挑战

多模态大模型(MMFMs)在个性化医学影像诊断中展现出巨大潜力,然而其在临床实践中的转化与系统集成面临诸多挑战,涵盖技术、用户接受度以及政策和文化等多个维度。
技术集成障碍是MMFMs临床转化的首要挑战。当前,MMFMs与现有临床工作流程的有效整合仍存在多重障碍,特别是与放射科信息系统(RIS)和图像存档与通信系统(PACS)的兼容性问题。这主要体现在缺乏标准化的API接口、数据传输协议的安全性和效率不足,以及系统间互操作性差等方面 。例如,尽管大语言模型(LLMs)可以定制以适应放射科的特定需求并与RIS和PACS无缝集成,但实现这一目标需要克服API接口标准化和数据传输安全效率等技术难题 。此外,MMFMs庞大的模型规模和计算需求使得在医院防火墙内部署变得困难,这引发了患者健康记录传输到外部模型提供商时的隐私和安全担忧 。尽管小型开源基础模型如LLaVA-Rad和CheXagent展现出与大型模型媲美的能力,使得本地部署更为可行,但仍需平衡模型能力、可部署性和安全性以弥合技术能力与实际实施之间的鸿沟 。
用户接受度与信任建立是MMFMs临床转化的关键非技术性障碍。医生对AI辅助诊断工具的接受程度和信任问题是阻碍MMFMs广泛应用的核心因素 。这种不信任感主要来源于医生对AI“黑箱”模型的不透明性、对潜在误诊风险的担忧以及对现有工作流程改变的抵触心理 。AI模型容易产生“幻觉”的倾向也可能导致医疗误诊,这进一步削弱了医疗专业人员的信任度 。为了提升医生信任度和采纳率,未来的研究应关注设计以人为中心(human-centered)的AI交互界面,包括可视化解释、可调节的自动化水平以及双向反馈机制,并优化人机交互和工作流程以减少压力并提高效率 。重要的是,MMFMs应补充而非取代放射科医生的专业知识,确保人机协作在医疗决策中发挥重要作用 。
政策与文化因素构成了更广泛的非技术性障碍。监管框架的碎片化、数据隐私风险、伦理困境以及各地区监管不一致,共同形成了复杂的合规性环境,严重阻碍了MMFMs的全球部署和临床转化 。例如,医疗软件需要一致且可复现的结果,这与MMFMs每次生成差异化内容的特性相悖,构成了监管挑战 。数据隐私是一个关键障碍,因为MMFMs依赖敏感的患者信息,同时需要遵守严格的匿名化规则(如GDPR)和跨境数据流限制,这增加了数据泄露风险 。目前,大多数医疗诊断中使用的MMFMs仍是商用模型,本地部署的MMFMs报告较少,这进一步引发了患者数据泄露的担忧 。此外,伦理风险,如算法中的性别或种族偏见以及不充分的患者同意流程,进一步加剧了公众的不信任感,尤其是在弱势群体中 。
公共信任与参与在AI系统成功部署中扮演着关键角色。AI技术在医疗领域的成功应用,公共信任和公众参与至关重要 。要建立这种信任,需要通过教育倡议提高公众对AI在医疗领域潜力的认识,消除误解,并提供准确、易懂的信息,解释AI技术的工作原理、局限性及其对患者预后的益处 。此外,必须促进AI开发者、医疗专业人员与公众之间的开放对话,通过公众咨询、市政厅会议和调查等形式,了解公众对AI的看法、担忧和期望 。将多样化的公共利益相关者纳入AI政策和应用决策过程,确保广泛的视角被考虑,从而使公众感觉参与到影响其医疗保健的决策中,更有可能信任AI技术和部署它们的机构 。总而言之,成功的整合不仅依赖于技术性能,更取决于其与临床实践的无缝衔接以及医生的积极参与,同时强调所有利益相关者(包括模型开发者、临床医生、政策制定者和数据集策展人)的协同努力至关重要 。
4. 展望与应对策略:未来发展与负责任应用
多模态大模型(MMFMs)在个性化医学影像诊断领域的快速发展,不仅预示着诊断范式的深刻变革,也对现有的监管框架、技术范式、数据管理与隐私保护,以及临床整合与人机协作模式提出了前所未有的挑战与机遇。本章旨在深入探讨MMFMs在未来发展中面临的关键议题,并提出相应的应对策略,以期实现其在医疗领域的负责任应用。
首先,随着MMFMs的日益复杂和广泛应用,构建健全、敏捷且具前瞻性的综合治理框架变得刻不容缓。这涵盖了从法律法规的制定、伦理准则的完善,到跨学科协作模式的构建,旨在确保人工智能技术在医疗领域得以安全、公平且负责任地应用,并能够适应人工智能技术的持续演进。现有研究强调,必须针对MMFMs在医疗领域的应用,制定专业的认证标准、风险评估框架和责任追溯机制,特别要明确当MMFMs发生误诊时的法律责任归属,这涉及开发商、医疗机构及最终使用医生等多个主体。为应对人工智能技术的快速迭代,监管框架必须具备高度敏捷性,能够随技术演进而不断更新,并推行敏捷监管、适应性监管以及灵活的人工智能验证和认证机制,同时政策制定者应定期审查并更新现有法律和指南,以预防监管空白并反映人工智能技术的最新状态及其影响。
其次,技术创新与模型优化是推动MMFMs向前发展的核心驱动力。这不仅包括对模型架构、训练方法和数据融合策略的持续改进,更重要的是,要将可解释性、鲁棒性及伦理考量贯穿于MMFMs的整个开发生命周期。传统深度学习模型在医学影像人工智能中发挥着关键作用,而视觉Transformer(ViTs)等新兴技术在高维影像数据处理和捕捉细微差异方面展现出卓越能力,预示着MMFMs将从单一模态处理向真正的多模态深度融合演进。研究者需特别关注通用图像与医学图像之间的独特属性和差异,并开发更适用于医学影像数据的自监督学习技术,如GLoRIA、ViLLA和BioViL等,以克服传统方法在捕捉医学图像局部特征时的局限性。此外,生成对抗网络(GANs)通过创建合成数据集和提升图像质量,为人工智能学习和使用医学影像提供了新的途径。在可解释性方面,未来研究应致力于发展基于因果推理的可解释人工智能,使模型能够提供诊断决策的因果链条,并通过反事实解释方法帮助医生理解诊断结果的敏感性。在鲁棒性方面,通过对抗性训练、模型校准和引入外部知识图谱等策略,降低模型“幻觉”并提高对噪声数据的抵御能力至关重要。伦理考量应贯穿MMFMs的整个开发生命周期,包括数据偏见检测、可解释性模块设计和跨领域伦理评估标准,以确保技术创新与社会责任同步发展。
再者,数据管理与隐私保护是MMFMs在个性化医学影像诊断中不可回避的核心挑战。患者隐私限制了大规模医疗数据的获取,因此如何在确保患者隐私的前提下实现数据可访问性和多样性成为当前研究的重点。隐私保护学习,特别是联邦学习(FL)和差分隐私(DP),被认为是克服数据孤岛和隐私泄露的有效途径,允许不同医疗机构在不共享原始数据的前提下协同训练MMFMs,同时遵守《通用数据保护条例》(GDPR)和《健康保险流通与责任法案》(HIPAA)等法规。同态加密(HE)和安全多方计算(SMPC)等前沿隐私增强技术也为实现医疗人工智能领域的数据安全共享和协作提供了解决方案。此外,数据匿名化和高级别安全措施,以及利用生成对抗网络(GANs)创建合成数据集,均是平衡患者隐私与个性化数据需求的关键策略。构建面向伦理评估的“多中心联邦学习基准数据集”是应对数据隐私与偏差问题的关键举措,该数据集应大规模、多中心、高度匿名,涵盖不同种族、性别、地域、疾病阶段的患者数据,并通过差分隐私等技术确保数据安全性,同时包含特定的“伦理挑战测试集”用于评估模型在处理偏见、隐私泄露和泛化性方面的性能。
最后,MMFMs的临床整合与人机协作优化是其真正落地应用的关键。未来的MMFMs发展应秉持以人为本的设计理念,以促进人工智能与临床实践的深度融合,通过建立标准化的数据接口、优化人机交互界面,并构建人工智能与医生协同工作的新模式,实现人工智能自动化能力与人类专业知识的优势互补。人工智能驱动的虚拟助手能够生成初步放射学报告,辅助放射科医生更迅速、明智地做出决策,从而减轻工作负担并提高诊断准确性。设计具备可视化解释、可调节自动化水平及双向反馈机制的以人为中心人工智能交互界面,可显著提升医生的信任度和采纳率。展望未来,人工智能与医生将形成“人机共生”的工作模式,即人工智能承担重复性任务,医生专注于复杂决策、人际沟通和人文关怀,从而提升整体医疗质量和效率。公共信任是人工智能在医疗领域成功整合的关键,通过教育公众、开放对话和社区参与,可以消除误解,确保人工智能技术的开发和部署符合社会价值观和期望。同时,优化人机协作的伦理界面设计,例如通过可视化工具清晰展示模型不确定性或提供“反事实解释”功能,能增强医生的主动性和决策信心,确保人工智能作为辅助工具而非决策主体。
综上所述,MMFMs在个性化医学影像诊断领域的未来发展与负责任应用,是一个涉及多维度、多层次的复杂系统工程。它不仅需要健全的法律法规和伦理框架,持续的技术创新与模型优化,严密的数据管理与隐私保护策略,以及以人为本的临床整合与人机协作优化,更需要政策制定者、技术开发者、临床医生、患者及社会公众等多方利益相关者的通力合作与持续对话。
4.1 综合治理:法规、政策与跨学科合作
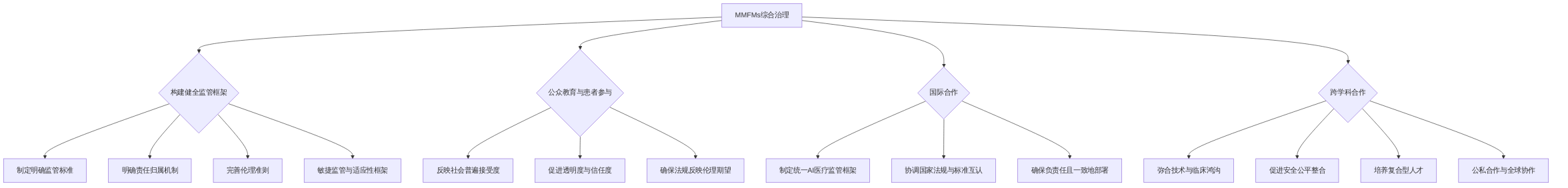
多模态基础模型(MMFMs)在个性化医学影像诊断中的快速发展,对其监管框架、伦理准则及跨学科合作模式提出了全新的挑战与机遇。未来的法规和政策需具备高度适应性与前瞻性,以应对人工智能(AI)技术的持续演进,确保其在医疗领域得以安全、公平且负责任地应用 。
首先,构建健全的监管框架至关重要。这包括制定明确的监管标准、责任归属机制以及伦理准则 。特别需要针对MMFMs在医疗领域的应用,制定专业的认证标准、风险评估框架和责任追溯机制 。例如,当MMFMs发生误诊时,法律责任的界定是一个复杂的问题,需要明确是归属开发商、医疗机构,还是最终使用医生 。为应对AI技术的快速迭代,监管框架必须足够敏捷,能够随技术演进而不断更新,推行敏捷监管、适应性监管以及灵活的AI验证和认证机制显得尤为必要 。同时,政策制定者应定期审查并更新现有法律和指南,以反映AI技术的最新状态及其影响,从而预防监管空白 。
其次,公众教育和患者参与在政策制定中扮演着不可或缺的角色。确保法规能够反映社会对AI医疗的普遍接受度和伦理期望,从而促进AI医疗应用的透明度和信任度。此外,随着AI在医疗保健中跨国应用的日益普遍,国际合作变得至关重要,以确保AI在不同医疗系统之间被负责任且一致地部署 。各国政策制定者应共同努力,制定统一的AI医疗监管框架,这可能涉及建立国际监管机构或加强现有组织(如世界卫生组织和国际标准化组织)之间的合作,以协调国家法规,并促进对AI技术在全球范围内的标准互认,确保其符合一致的伦理和法律标准 。
再者,跨学科合作是推动多模态基础模型发展的核心要素。要弥合AI技术能力与实际临床实施之间的鸿沟,促进AI工具在医疗领域的负责任整合,需要模型开发者、临床医生、政策制定者和数据集策展人等所有利益相关者的协同努力 。文章明确指出,促进医疗、技术和学术部门之间的合作,是构建AI与医学影像协同作用以增强患者护理和重塑医疗保健格局的关键 。MMFMs在医学影像诊断领域的发展需要医学、计算机科学、伦理学、法律等多个领域的跨学科合作 。这不仅有助于共同攻克MMFMs在个性化医学影像诊断中的技术和非技术挑战,例如无缝数据集成、系统互操作性以及确保AI在医疗环境中的伦理使用 ,而且有助于培养具备多学科知识背景的人才 。建议在医学院和工学院中设立交叉学科项目,培养既懂医学知识又掌握AI技术的复合型人才,同时加强对医生和技术人员的伦理培训,确保AI技术的负责任应用。政府、监管机构和私营部门之间的公私合作以及全球合作,在负责任地部署AI方面发挥着关键作用,通过统一监管框架和跨境数据共享协议,促进AI驱动的个性化医疗的公平获取 。
综上所述,MMFMs在个性化医学影像诊断领域的负责任发展,离不开全面且敏捷的监管框架,以及医疗、技术、伦理、法律等多领域的深度跨学科合作。这不仅能确保AI技术的安全与公平应用,更能推动其在医疗健康领域的潜力充分释放,最终造福患者。
4.2 技术创新与模型优化
多模态大模型(MMFMs)在个性化医学影像诊断中的未来发展,将显著依赖于模型架构、训练方法和数据融合层面的技术创新。在模型架构方面,传统深度学习模型如卷积神经网络(CNNs)已在医学影像AI中发挥关键作用,而视觉Transformer(ViTs)作为新兴技术,展现出在全局图像分析、高维影像数据处理以及捕捉细微差异方面的卓越能力。未来,MMFMs将逐步从单一模态处理向真正的多模态深度融合演进,这要求开发更强大的数据融合架构,例如结合先进的图像编码器(如ViTs)、图神经网络(GNNs)与MMFMs的端到端架构,以实现影像特征与文本语义的深度融合。研究表明,利用外部工具(如图像阅读器、搜索引擎)能够显著扩展大语言模型(LLMs)的功能,克服训练数据过时的限制,并支持不适合文本形式的任务,这为多模态融合提供了新的思路。
在训练方法方面,高效的预训练和微调对于提升MMFMs在复杂医学影像诊断任务中的性能和泛化能力至关重要。研究者应利用通用领域多模态自监督学习技术的最新进展,但需特别关注通用图像与医学图像之间的独特属性和差异。与自然图像不同,医学图像的类别定义特征通常更局部和细微,如异常病灶。因此,依赖全局图像和文本特征联合表示的传统自监督方法(如CLIP)在捕捉这些微妙、局部特征时可能存在局限性。为解决此挑战,研究者已提出GLoRIA、ViLLA和BioViL等创新方法,以使自监督学习技术更适用于医学影像数据的独特属性。未来应通过多任务学习、对比学习或知识蒸馏等方法,在医学特定数据集上进行高效的预训练和微调,并引入技术创新来调整通用领域方法,以更好地捕捉医学图像的特点。此外,生成对抗网络(GANs)通过创建合成数据集来解决数据量限制,并通过从低质量扫描重建高分辨率图像来提升图像质量,是改变AI学习和使用医学影像方式的关键技术之一。
数据融合是提升MMFMs诊断能力的核心。未来研究应专注于将文本、影像和结构化临床数据(如实验室结果、基因组档案)整合到统一的多模态框架中,并结合更多生物标志物和多组学数据,以实现更全面的信息整合和个性化诊断。这包括开发跨模态对齐技术,以协调文本症状、影像发现(如MRI异常)和生物标志物模式之间的语义关系。
可解释性与鲁棒性是MMFMs在医学领域负责任部署的关键。未来研究应致力于提高MMFMs的可解释性,例如发展基于因果推理的可解释AI,使模型能够提供诊断决策的因果链条,而非仅仅关联性解释。反事实解释方法将帮助医生理解“如果病变特征稍有不同,诊断结果会如何变化”。此外,开发“推理链”框架将LLM的诊断路径可视化,明确将症状输入与疾病假设通过中间证据联系起来,是增强模型透明度的重要方向。在鲁棒性方面,应采用对抗性训练、模型校准以及引入外部知识图谱进行事实核查等策略,以降低模型“幻觉”并提高对噪声数据的抵御能力。实施对抗性测试协议以量化模型在模糊表征中的不确定性也至关重要。同时,针对MMFMs的幻觉问题,需要开发更先进的机制来验证模型输出的真实性和医学准确性,例如结合知识图谱或可信医学数据库进行实时事实核查,并引入置信度评估机制,在模型不确定时发出警报。在医学报告生成等任务中,需要开发更符合临床实际的评估指标(如CheXpromt),以确保生成的报告在事实准确性和临床实用性方面与人类放射科医生评估无统计学差异。
伦理考量应贯穿MMFMs的整个开发生命周期。未来的多模态AI系统开发应融入伦理考量的技术框架,包括数据偏见检测、可解释性模块设计和跨领域伦理评估标准,以确保技术创新与社会责任同步发展。更重要的是,未来研究应超越目前的提示调优和人类反馈强化学习,探索能够从根本上减少模型偏见的方法,例如开发新的公平性约束算法,或者构建更加多样化、去偏的预训练数据集。同时,持续监控MMFMs的公平性也是不可或缺的环节。
4.3 数据管理与隐私保护策略
在多模态大模型(MMFMs)应用于个性化医学影像诊断的过程中,数据管理与隐私保护是核心挑战,直接影响模型在更大规模数据集上的训练与部署可行性。患者隐私限制了大规模医疗数据的获取,成为MMFMs开发的主要障碍。因此,如何在确保患者隐私的前提下实现数据可访问性和多样性,成为当前研究的重点。
为应对数据隐私问题,隐私保护学习(Privacy-Preserved Learning)成为多模态AI在医疗领域面临的关键伦理挑战之一,推动了对先进隐私保护技术的开发和应用。其中,联邦学习(Federated Learning, FL)和差分隐私(Differential Privacy, DP)被广泛认为是克服数据孤岛和隐私泄露的有效途径。联邦学习允许不同医疗机构在原始患者数据不离开本地的前提下,协同训练MMFMs,从而实现了多中心数据的安全共享与协作,同时遵守《通用数据保护条例》(GDPR)和《健康保险流通与责任法案》(HIPAA)等法规。差分隐私技术则通过在模型训练过程中注入噪声来保护个体数据隐私,从而在平衡隐私保护与模型性能之间提供了解决方案。
除了联邦学习和差分隐私,同态加密(Homomorphic Encryption, HE)和安全多方计算(Secure Multi-Party Computation, SMPC)等前沿隐私增强技术也被提出用于在医疗AI领域实现数据安全共享和协作。这些技术旨在确保数据安全的前提下实现多中心协作和模型训练。在实际应用中,强制要求所有临床试验和实际部署中明确报告所采取的数据安全和隐私保护措施,并探索基于零知识证明等更前沿的隐私增强技术至关重要。
数据匿名化和高级别安全措施是平衡患者隐私与个性化数据需求的关键。患者去识别化数据的捐赠以及普遍的电子影像交换被提倡,以提高数据可访问性和多样性,从而应对大规模医疗数据训练模型的挑战。此外,利用生成对抗网络(GANs)创建合成数据集是规避敏感信息使用的间接方法,其能够生成逼真且匿名的图像,为AI系统提供安全的训练环境。
在数据管理方面,除了传统的医疗数据获取途径,创新性的数据获取方法也日益关键,例如利用PubMed图像和图片说明、从医学教科书中提取文本和图像,以及从Twitter等社交媒体平台挖掘相关帖子。然而,需注意来自公共来源的大规模数据集可能无法满足临床应用所需的严格标准,因此未来的模型开发必须仔细权衡数据数量与质量,以确保AI模型在现实医疗应用中既强大又可靠。
为促进医疗AI的伦理发展,未来的研究应超越目前的提示调优和人类反馈强化学习,探索能够从根本上减少模型偏见的方法,例如开发新的公平性约束算法,或者构建更加多样化、去偏的预训练数据集。构建面向伦理评估的“多中心联邦学习基准数据集”是应对数据隐私与偏差问题的关键举措。该数据集应大规模、多中心、高度匿名,涵盖不同种族、性别、地域、疾病阶段的患者数据,并通过差分隐私等技术确保数据安全性。同时,数据集应包含特定的“伦理挑战测试集”,用于评估模型在处理偏见、隐私泄露和泛化性方面的性能,为模型的伦理评估提供统一标准。
综上所述,未来数据管理与隐私保护策略应着重于高质量数据集的构建、多中心数据的安全共享与协作,并推动全球医疗AI监管标准的统一。平衡个性化数据需求与患者隐私的伦理和法律问题至关重要,需要持续强调数据匿名化和高级别安全措施,以应对大规模医疗数据训练模型的挑战。
4.4 临床整合与人机协作优化
多模态基础模型(MMFMs)在医学影像诊断中的临床整合,要求系统性地优化数据接入、改善用户界面,并实现人工智能(AI)与临床医生之间的高效协同。未来的MMFMs发展应秉持以人为本的设计理念,以促进AI与临床实践的深度融合。
为实现AI与临床工作流程的无缝衔接,亟需建立标准化的数据接口、优化人机交互界面,并构建AI与医生协同工作的新模式。AI的自动化能力可显著提升医学影像过程的效率,例如,AI驱动的虚拟助手能够生成初步的放射学报告,使放射科医生得以专注于审阅与改进,而非从零开始,从而减轻工作负担,提高效率。此外,AI可作为虚拟助手提供实时反馈、建议潜在诊断,辅助放射科医生更迅速、明智地做出决策,进而提高诊断准确性并预防职业倦怠。AI系统与人类智能之间存在差异性,机器智能应作为辅助工具而非替代者,这强调了AI与人类专业知识结合的关键性,以实现更高效、精准和以患者为中心的诊断。Med-Gemini等模型通过整合在线搜索功能来验证其输出,为增强AI辅助医疗决策的可靠性和安全性提供了宝贵先例。
设计以人为中心(human-centered)的AI交互界面至关重要,这类界面应具备可视化解释、可调节的自动化水平以及双向反馈机制,以显著提升医生的信任度和采纳率。这包括开发能够提供多重证据(如影像、报告、参考文献)支持的交互式诊断系统,并允许医生在诊断过程中对AI的推理路径进行修正或补充。展望未来,AI与医生将形成“人机共生”的工作模式,即AI承担重复性、高强度任务,而医生专注于复杂决策、人际沟通和人文关怀,从而提升整体医疗质量和效率。尽管某些研究并未详细阐述优化人机交互界面、设计智能辅助工具以及实现AI与医生无缝协作的具体技术细节,但均强调了AI与医生协作以及以人为本的AI系统的重要性。
针对MMFMs在处理复杂、不确定临床情境时的不足,以及有限的上下文窗口,应展望开发具备“动态信息获取与推理”能力的MMFMs。这使得模型能够像医生一样进行追问、筛选关键信息,并结合实时检验和影像结果进行迭代诊断。同时,LLMs在放射学中虽具有巨大潜力,但应作为放射科医生专业知识的补充,而非取代。LLMs可通过定制以适应放射科特定需求,并与现有PACS和放射信息系统(RIS)无缝集成。
公共信任是AI在医疗领域成功整合的关键。公众参与对于建立信任、解决担忧以及确保AI技术的开发和部署符合社会价值观和期望至关重要。通过教育公众,提供关于AI工作原理、局限性及其对患者益处的准确信息,可以消除误解,并使公众能够做出明智的决策。开放对话和社区参与,包括患者倡导团体和伦理委员会的参与,可以确保更广泛的视角被纳入AI政策和应用决策中。此外,解决非技术性障碍,如医生对“黑箱”模型的不信任、对数据代表性的担忧以及对潜在误诊责任的模糊性,对于推动临床应用至关重要。
优化人机协作的伦理界面设计至关重要。在临床应用中,多模态AI不应取代医生,而是作为辅助工具。未来的研究应着重设计伦理驱动的人机交互界面,例如,通过可视化工具清晰展示模型在整合不同模态数据时的不确定性,或者提供“反事实解释”功能,让医生能够探索“如果某个影像特征不同,诊断结果会如何变化”。这样的界面设计能增强医生的主动性和决策信心,确保AI作为工具而非决策主体。通过优化人机协作,可以加速MMFMs在个性化医学影像诊断领域的临床转化和广泛应用。为了加速MMFMs在个性化医学影像诊断领域的临床转化和广泛应用,需要进行大规模前瞻性试验,比较MMFM辅助诊断与传统诊断流程,并评估其在诊断时间、成本效益和诊断错误率方面的表现。
5. 结论
多模态基础模型(MMFMs)在个性化医学影像诊断领域展现出巨大的变革性潜力,预示着精准医疗的广阔前景。这些模型通过整合影像、临床数据、文本和基因组信息等多种模态,显著提升了诊断准确性、疾病分类和医学问答的能力。例如,多模态自监督预训练已被证明可显著提升下游任务性能,增益高达439%。生成式视觉-语言模型(VLMs),如Med-PaLM Multimodal,进一步展示了处理多种模态和执行广泛任务的通用性,为AI辅助医疗决策提供了新的路径。
然而,MMFMs的快速发展也伴随着一系列必须认真应对的挑战。数据获取与管理是核心难题,包括数据稀缺、多样性不足以及无缝集成与互操作性问题。尽管创新性的数据收集方法(如利用PubMed图像和社交媒体数据)正在帮助克服这些障碍,但数据质量与数量之间的平衡仍需关注。其次,伦理和法律考量至关重要,具体体现在数据隐私、知情同意、偏见、模型幻觉、问责制和责任归属等方面。多模态系统需要收集更多用户数据,从而增加了数据被滥用的风险,并可能加剧现有的数据偏差问题,导致公平性受损和模型幻觉现象,威胁患者安全。
此外,模型性能和临床转化也是亟待解决的问题。尽管大型模型展现出强大能力,但其高计算需求和部署挑战不容忽视。同时,模型的可解释性、鲁棒性以及在真实临床环境中的有效集成和人机协作优化,对于建立医患信任和实现临床效益至关重要。小型开源模型如LLaVA-Rad和CheXagent的出现为本地部署提供了可行性,而Med-Gemini等通过整合在线搜索验证输出,有助于提升AI辅助决策的可靠性与安全性。
鉴于上述机遇与挑战,未来的研究应重点关注以下几个方面,以推动该领域健康可持续发展:首先,应继续在数据伦理、隐私保护学习和泛化性方面进行深入研究,确保数据安全和用户同意,同时开发公平和有代表性的模型以减少偏见。其次,模型可解释性与鲁棒性是关键,需开发透明解释推理过程的系统,并通过对抗性测试等方法增强模型的稳定性与可靠性,以应对“幻觉”等问题。再者,临床转化和法规政策完善刻不容缓,需制定国际化的监管标准和伦理准则,以确保MMFMs在医疗系统中的公平、安全和负责任部署。
最后,MMFMs的未来发展不仅是技术问题,更是一个跨学科合作、伦理规范和政策引导的综合性工程。技术专家、医疗服务提供者、法律专家、政策制定者和数据集策展人之间的紧密合作至关重要,以构建一个AI与医学影像协同工作、增强患者护理的未来,从而确保其安全、公平和负责任地应用于临床实践,最终实现其变革性价值,推动精准医疗的全面实现。
References
Large Language Models in Medical Diagnostics: Scoping Review With Bibliometric Analysis https://www.jmir.org/2025/1/e72062
Multimodal Foundation Models for Medical Imaging - A Systematic Review and Implementation Guidelines | medRxiv https://www.medrxiv.org/content/10.1101/2024.10.23.24316003v1.full-text
Redefining Radiology: A Review of Artificial Intelligence Integration in Medical Imaging https://pubmed.ncbi.nlm.nih.gov/37685300/
How does multimodal AI contribute to AI ethics? - Milvus https://milvus.io/ai-quick-reference/how-does-multimodal-ai-contribute-to-ai-ethics
The Future of Radiology: AI's Transformative Role in Medical Imaging - RSNA https://www.rsna.org/news/2025/january/role-of-ai-in-medical-imaging
Future of AI in medical imaging: Challenges and opportunities - Quibim https://quibim.com/news/ai-in-medical-imaging/
Ethical and legal considerations in healthcare AI: innovation and policy for safe and fair use https://pmc.ncbi.nlm.nih.gov/articles/PMC12076083/
The Future of AI in Medical Imaging: Transforming Healthcare With Technology in 2025 https://blog.medicai.io/en/future-of-ai-in-medical-imaging/
The future of multimodal artificial intelligence models for integrating imaging and clinical metadata: a narrative review - PubMed https://pubmed.ncbi.nlm.nih.gov/39354728/
Large language models in radiology: fundamentals, applications, ethical considerations, risks, and future directions - PubMed Central https://pmc.ncbi.nlm.nih.gov/articles/PMC10916534/
Ethical Development and Evaluation of Multi-Modal AI in Healthcare https://impactlabasu.github.io/
