0. CRISPR 碱基编辑治疗遗传性视网膜病的最新进展综述
1. 遗传性视网膜病:疾病负担、遗传异质性与精准治疗的需求
遗传性视网膜病变(IRDs)是导致全球范围内视力障碍和失明的主要原因,其显著的疾病负担与目前治疗手段的局限性共同凸显了对精准治疗策略的迫切需求。IRDs表现出高度的临床和遗传异质性,这为基因治疗,特别是碱基编辑技术,带来了独特的挑战。

IRDs涵盖了多种临床表型,包括视网膜色素变性(RP)、Stargardt病、莱伯先天性黑蒙(LCA)和锥杆细胞营养不良(CD)等,并且与超过280个基因的突变相关,例如ABCA4、RPE65、CEP290和USH2A等致病基因。Stargardt病最常见的致病原因是ABCA4基因突变,而RPE65和CEP290基因突变则与LCA密切相关。
不同研究中报告的IRDs流行病学数据和基因突变谱显示出显著差异,直接影响了基因治疗靶点的选择和策略制定。例如,Stargardt病患者队列的基因突变谱研究揭示了地理和人群特异性。在德国队列中,38%的患者至少携带一个复杂等位基因,其中德国特有的复杂等位基因c.5714+5G>A; p.(Ala1905Valfs*4)占所有复杂等位基因的34%。相比之下,丹麦队列中复杂等位基因的比例仅为6.5%,且多为德国常见的创始突变c.2588G>C; p.(Gly863Ala) 。在中国队列中,3.5%的患者存在复杂等位基因(即两个或三个突变)。这些数据表明,不同人群间的基因突变类型和复杂等位基因分布存在显著差异,为碱基编辑治疗策略的个性化制定提供了关键的流行病学依据。
这种高度的遗传异质性对基因治疗,尤其是精确的碱基编辑技术,提出了独特的挑战。全球范围内的治疗策略制定必须充分考虑不同患者队列中基因突变谱的差异性,以针对不同的基因和突变类型开发特异性治疗方法。例如,对于ABCA4基因的复杂等位基因,如c.2588G>C,其致病性还可能依赖于是否与c.5603A>T在顺式(cis)上共存,这进一步凸显了突变间相互作用对临床表型复杂性的影响,增加了基因编辑策略的复杂性。
现有流行病学和基因突变数据存在局限性。研究指出,即使在已确诊的ABCA4相关疾病患者中,仍存在较高比例的单等位基因突变(20-25%)和“无突变”病例(10-15%)。例如,在德国队列中,5.5%的ABCA4患者仅检测到一个突变但表现出相关疾病表型,这提示了疾病诊断和遗传学分析的复杂性,以及可能存在的未识别致病变异。此外,不同人种间基因突变谱的差异研究仍显不足,且现有流行病学数据可能对罕见突变的覆盖不足。这些研究空白限制了对所有IRDs患者进行全面基因诊断和精准治疗的能力,也为未来基因组学研究和治疗策略的开发指明了方向,强调了扩大基因检测范围和深化对罕见突变、复杂等位基因相互作用及其在不同人群中分布规律的认识,以更好地指导基于碱基编辑的基因治疗策略的制定。

目前针对IRDs的传统治疗方案及现有基因替代疗法普遍存在显著局限性,无法从根本上逆转或阻止疾病进展。传统的支持性疗法和药物治疗通常仅能缓解症状或延缓疾病进程,无法纠正根本的基因缺陷。
基因替代疗法,如通过腺相关病毒(AAV)载体介导的基因补充,在治疗由基因功能丧失引起的疾病方面取得了一定成功,例如RPE65基因替代疗法Luxturna。然而,这类疗法面临多重挑战。首先,AAV载体容量有限,难以递送较大的基因,例如在视网膜疾病中常见的ABCA4基因。其次,基因替代疗法仅适用于特定类型的突变,如基因功能丧失突变,而对于显性遗传疾病或占IRDs突变类型大多数的单碱基点突变,其治疗效果不佳。此外,反复给药可能引发不良免疫反应,进一步限制了其临床应用。
鉴于传统治疗方案的上述不足,基因编辑技术,特别是CRISPR/Cas系统,为精准治疗遗传性视网膜病变带来了新的希望,体现出其战略性必要性。碱基编辑技术作为CRISPR/Cas9的衍生物,通过直接纠正基因组中的致病单碱基突变,提供了从根本上治疗IRDs的策略。与传统的CRISPR/Cas9核酸酶相比,碱基编辑技术无需诱导DNA双链断裂(DSBs),从而显著降低了脱靶编辑、染色体易位和细胞毒性等潜在安全风险,有望实现更精准、更安全的基因修复,尤其在纠正单碱基突变方面展现出独特的优势和变革性潜力。
综合来看,遗传性视网膜病的巨大疾病负担与现有治疗方案的局限性共同凸显了基因编辑技术在精准治疗中的战略必要性。
1.1 遗传性视网膜病的临床与遗传异质性
遗传性视网膜疾病(IRDs)是全球范围内导致失明和视力障碍的主要原因之一,其临床与遗传异质性显著,为基因治疗策略的开发带来了巨大挑战 。IRDs涵盖了多种临床表型,如视网膜色素变性(RP)、Stargardt病、莱伯先天性黑蒙(LCA)和锥杆细胞营养不良(CD)等,并且与超过280个基因的突变相关 。其中,ABCA4、RPE65、CEP290和USH2A是与这些疾病相关的常见致病基因。例如,ABCA4基因突变是Stargardt病最常见的致病原因,而RPE65和CEP290基因突变则与LCA密切相关 。
不同研究中报告的IRDs流行病学数据和基因突变谱呈现出显著差异,这直接影响了基因治疗(特别是碱基编辑)的靶点选择和策略制定。例如,对Stargardt病患者队列的基因突变谱研究揭示了地理和人群特异性。在德国队列中,38%的患者至少携带一个复杂等位基因,其中德国特有的复杂等位基因c.5714+5G>A; p.(Ala1905Valfs*4)占所有复杂等位基因的34% 。相较之下,丹麦队列中复杂等位基因的比例仅为6.5%,且多为德国常见的创始突变c.2588G>C; p.(Gly863Ala) 。在中国队列中,3.5%的患者存在复杂等位基因(即两个或三个突变)。这些数据突出表明,不同人群间的基因突变类型和复杂等位基因分布存在显著差异,为碱基编辑治疗策略的个性化制定提供了关键的流行病学依据 。
这种高度的遗传异质性对基因治疗,尤其是精确的碱基编辑技术,提出了独特的挑战。由于需要针对不同的基因和突变类型开发特异性治疗方法,全球范围内的治疗策略制定必须充分考虑不同患者队列中基因突变谱的差异性 。例如,对于ABCA4基因的复杂等位基因,如c.2588G>C,其致病性还可能依赖于是否与c.5603A>T在顺式(cis)上共存,这进一步凸显了突变间相互作用对临床表型复杂性的影响,并增加了基因编辑策略的复杂性 。
现有流行病学和基因突变数据的局限性也值得批判性评估。研究指出,即使在已确诊的ABCA4相关疾病患者中,仍存在较高比例的单等位基因突变(20-25%)和“无突变”病例(10-15%)。例如,在德国队列中,5.5%的ABCA4患者仅检测到一个突变但表现出相关疾病表型,这提示了疾病诊断和遗传学分析的复杂性,以及可能存在的未识别致病变异 。此外,不同人种间基因突变谱的差异研究仍显不足,且现有流行病学数据可能对罕见突变的覆盖不足。这些研究空白限制了对所有IRDs患者进行全面基因诊断和精准治疗的能力,也为未来基因组学研究和治疗策略的开发指明了方向,强调了扩大基因检测范围和深化对罕见突变、复杂等位基因相互作用及其在不同人群中分布规律的认识,以更好地指导基于碱基编辑的基因治疗策略的制定。
1.2 现有治疗局限性与基因编辑的战略必要性
遗传性视网膜病变(IRDs)是导致不可逆失明的主要原因之一,然而,目前针对IRDs的传统治疗方案及现有基因替代疗法普遍存在显著局限性,无法从根本上逆转或阻止疾病进展 。传统的支持性疗法和药物治疗通常仅能缓解症状或延缓疾病进程,无法纠正根本的基因缺陷 。
基因替代疗法,如通过腺相关病毒(AAV)载体介导的基因补充,在治疗由基因功能丧失引起的疾病方面取得了一定成功,例如RPE65基因替代疗法Luxturna 。然而,这类疗法面临多重挑战。首先,AAV载体容量有限,难以递送较大的基因,例如在视网膜疾病中常见的ABCA4基因 。其次,基因替代疗法仅适用于特定类型的突变,如基因功能丧失突变,而对于显性遗传疾病或占IRDs突变类型大多数的单碱基点突变,其治疗效果不佳 。此外,反复给药可能引发不良免疫反应,进一步限制了其临床应用 。
鉴于传统治疗方案的上述不足,基因编辑技术,特别是CRISPR/Cas系统,为精准治疗遗传性视网膜病变带来了新的希望,体现出其战略性必要性 。碱基编辑技术作为CRISPR/Cas9的衍生物,通过直接纠正基因组中的致病单碱基突变,提供了从根本上治疗IRDs的策略 。与传统的CRISPR/Cas9核酸酶相比,碱基编辑技术无需诱导DNA双链断裂(DSBs),从而显著降低了脱靶编辑、染色体易位和细胞毒性等潜在安全风险,有望实现更精准、更安全的基因修复,尤其在纠正单碱基突变方面展现出独特的优势和变革性潜力 。
综合来看,遗传性视网膜病的巨大疾病负担与现有治疗方案的局限性共同凸显了基因编辑技术在精准治疗中的战略必要性。接下来的章节将深入探讨这一技术的演进及其在眼科疾病中的应用。
2. CRISPR/Cas系统:从基因敲除到精准碱基编辑的演进
CRISPR/Cas系统作为一项具有革命性意义的基因编辑技术,其发展历程标志着基因组工程从粗放式基因敲除向精准单碱基编辑的演进。最初,该系统主要依赖于Cas9核酸酶在特定DNA位点制造双链断裂(DSB),从而通过细胞内修复机制实现基因敲除或精确修复。然而,DSB固有的脱靶效应和基因毒性风险,极大地限制了其临床转化应用。为了克服这些挑战,基因编辑领域的研究重点逐渐转向开发更安全、更精确的技术,尤其是碱基编辑(Base Editing)技术,它能够在不产生DSB的情况下实现单碱基的精确转换。这一演进不仅拓宽了基因编辑的应用范围,也为治疗由点突变引起的遗传性疾病,特别是遗传性视网膜病变,提供了前所未有的机遇。
2.1 传统CRISPR/Cas9的原理与早期应用
CRISPR/Cas9技术作为一种革新性的基因编辑工具,其核心工作原理依赖于Cas9核酸酶和引导RNA(gRNA)对特定DNA序列的靶向切割能力。gRNA,通常包含一个约20个核苷酸的间隔序列,负责与靶DNA序列进行互补配对,并引导Cas9酶精确到达目标基因组位点。Cas9酶在识别到靶序列旁侧的特定原间隔序列邻近基序(PAM),通常是NGG(其中N代表任意核苷酸,G代表鸟嘌呤)后,会在PAM序列上游的3-4个碱基处制造DNA双链断裂(DSB)。
DSB的修复主要通过细胞内的两种途径实现:非同源末端连接(NHEJ)和同源重组修复(HDR)。NHEJ是一种高效但易错的修复机制,常导致小片段的插入或缺失(indel),从而实现基因敲除或引起移码突变,这在治疗由功能增益突变引起的常染色体显性遗传视网膜病变中具有应用潜力,例如通过敲除突变等位基因以降低有害蛋白的表达。相比之下,HDR是一种精确修复途径,需要同源DNA模板的存在,常用于引入精确的基因修正或替换。在眼科疾病治疗的早期应用中,CRISPR/Cas9已被用于莱伯先天性黑蒙(LCA)小鼠模型中Rpe65基因突变的纠正,通过HDR途径精确修复致病突变,进而恢复基因功能。
尽管CRISPR/Cas9在体外细胞模型和体内动物模型中展现出巨大潜力,但其在临床转化中面临显著挑战。DSB带来的潜在基因毒性是主要的安全顾虑,因为不可预测的indel甚至染色体易位可能导致细胞毒性和基因组不稳定性。此外,脱靶效应是另一关键局限性,Cas9在非靶位点产生切割可能引发不必要的突变,尤其是在视网膜这种高度分化的细胞中,脱靶切割的累积效应可能导致不可逆的细胞损伤。这些固有的局限性驱动了对更精准基因编辑技术的研发,为后续碱基编辑等新兴技术的引入奠定了坚实的逻辑基础。在不同研究中,CRISPR/Cas9的编辑效率与安全性数据存在差异,其在临床转化中的普适性仍需批判性评估。总而言之,传统CRISPR/Cas9在眼科应用中展现出初步成功,特别是在概念验证阶段,但DSB诱导的基因毒性和脱靶风险是其普遍存在的局限性,促使研究人员寻求更安全、更精准的基因编辑策略。
2.2 碱基编辑技术(ABE与CBE)的核心机制、优势与应用进展
碱基编辑技术是对CRISPR/Cas9基因编辑系统的重大改进,其核心在于通过将失活的Cas蛋白(如切口酶活性Cas9或完全失活Cas9)与特异性核酸脱氨酶融合,实现对单碱基的精确转换,而无需在DNA中引入双链断裂(DSB)。这种无DSB的编辑机制显著降低了传统CRISPR/Cas9技术固有的插入/缺失(indel)和染色体易位风险,从而提高了编辑的安全性和精确性,使其成为纠正由点突变引起的遗传性疾病的理想工具。

具体而言,腺嘌呤碱基编辑器(ABE)和胞嘧啶碱基编辑器(CBE)是两种主要的碱基编辑系统,各自针对不同的碱基转换类型:
- 胞嘧啶碱基编辑器(CBE):CBE通常由Cas9n或dCas9与胞嘧啶脱氨酶(如APOBEC1)融合构建。其作用机制是胞嘧啶脱氨酶将靶DNA中的胞嘧啶(C)脱氨基转化为尿嘧啶(U)。在DNA复制或修复过程中,细胞内机制会将U识别为胸腺嘧啶(T),最终实现C·G碱基对到T·A碱基对的精确转换。
- 腺嘌呤碱基编辑器(ABE):ABE则由Cas9n或dCas9与腺嘌呤脱氨酶(如tRNA腺嘌呤脱氨酶TadA的突变体)融合构建。ABE能够催化靶DNA中的腺嘌呤(A)脱氨基转化为肌苷(I)。肌苷在细胞内被识别为鸟嘌呤(G),从而实现A·T碱基对到G·C碱基对的精确转换。
相较于传统的CRISPR/Cas9技术,碱基编辑的主要优势在于其“切口修复”而非“断裂修复”机制,即不产生DSB。这显著降低了脱靶indel和染色体易位等基因毒性风险,极大地提高了编辑的精确性和安全性,特别适用于纠正由单碱基点突变引起的遗传性疾病,这类突变在遗传性疾病中占据了很大比例。例如,在遗传性视网膜病中,许多疾病如Stargardt病正是由单碱基突变所致,碱基编辑为这些疾病的治疗提供了更安全、更精准的策略。
然而,碱基编辑技术仍面临挑战,包括编辑窗口和PAM位点的限制。编辑窗口是指脱氨酶作用的区域通常覆盖多个碱基,可能导致靶向碱基附近的“旁观者”碱基(bystander editing)也被编辑,从而引起不必要的突变。例如,CBE的编辑窗口通常为sgRNA结合位点下游的第4-8位碱基,而ABE的编辑窗口则为第4-7位碱基。虽然较小的编辑窗口有助于提高精度,但大的编辑窗口可能增加旁观者编辑的风险,这在诸如ABCA4基因这样已知有约1200个致病变异的基因中尤为突出,可能导致有害的旁观者编辑。
此外,与传统CRISPR/Cas9类似,碱基编辑也依赖于特定的PAM序列(如NGG),这限制了其靶向范围。尽管新型的PAM变体(如NAG、NGA)已经扩展了其靶向范围,但在某些基因区域仍可能受限。然而,研究表明,非规范PAM位点(如NAG和NGA)也能有效地被靶向,例如使用SpCas9靶向这些位点时,观察到高达29%的编辑效率,远高于柔性xCas9的3.7%。这种扩展的PAM灵活性极大地拓宽了可靶向的突变范围。
在纠正导致遗传性视网膜病的致病突变方面,ABE和CBE展现出巨大的应用潜力。例如,在针对ABCA4基因的致病突变修复中,研究人员已经成功利用ABE和CBE在体外和体内模型中实现了精确的碱基修复,部分恢复了视网膜功能。对ABCA4基因致病性突变的分析显示,大多数转换突变(C>T, G>A, A>G, T>C)都拥有至少一个可用的近邻PAM位点,特别是在患者数据中,这为碱基编辑提供了广阔的靶向范围。例如,德国队列中91%的复合杂合突变患者具有相关PAM位点,其中76%具有不止一个PAM位点。丹麦和中国队列中,分别有68%和76%的患者具有“理想”PAM位点,其中约一半患者具有多个PAM位点,这提供了设计编辑策略的灵活性。
在比较CBE与ABE的性能时,两者在编辑窗口、脱靶风险和应用场景上存在异同。CBE主要用于C>T转换,而ABE主要用于A>G转换,因此它们在实现特定基因修正方面具有互补性。虽然SpCas9在体外和体内表现良好,但其较大的尺寸限制了递送效率,而SaKKH的编辑窗口较大,虽然能靶向更多变异,但也可能带来更高的旁观者编辑风险。影响其性能的关键因素包括递送方式和靶点可及性。在视网膜基因治疗中,这两种技术都具有巨大的潜力,共同解决了传统CRISPR/Cas9在点突变治疗上的局限性,为遗传性视网膜病的精准治疗提供了新的范式。未来研究应着力于优化递送系统、进一步缩小编辑窗口以降低旁观者编辑风险,并探索新型PAM变体以拓宽靶向范围,以期实现更高效、更安全的基因治疗。
3. 碱基编辑在遗传性视网膜病治疗中的应用进展与策略选择
遗传性视网膜病(IRDs)是一组由基因突变引起的眼部疾病,其临床表现多样,从局部视力障碍到完全失明,严重影响患者的生活质量。在基因治疗领域,CRISPR碱基编辑技术因其在单碱基分辨率上精准纠正致病性突变的能力,为这些疾病带来了前所未有的治疗前景。该技术的核心优势在于无需引入双链DNA断裂,从而显著降低了脱靶效应和染色体重排的风险。本章将深入探讨碱基编辑技术在遗传性视网膜病治疗中的最新进展与策略选择,重点分析其在Stargardt病中的应用潜力,并展望其在其他IRDs治疗中的探索与面临的挑战。通过系统性地回顾当前研究,本章旨在为读者提供一个全面的视角,理解碱基编辑在眼科基因治疗领域所取得的突破及其未来发展方向。

针对Stargardt病(STGD1)这一常见的遗传性视网膜黄斑变性疾病,碱基编辑技术展现出巨大的临床转化潜力。STGD1主要由ABCA4基因的单碱基突变引起,这些突变通常是碱基转换(C>T或G>A)类型。研究统计显示,在不同患者队列中,由碱基转换引起的ABCA4错义突变占据了所有错义突变的32.7%至34.9%,这意味着这些突变原则上均可通过碱基编辑器进行纠正。具体而言,胞嘧啶碱基编辑器(CBE)能够纠正约17.9%的Stargardt病相关错义突变,而腺嘌呤碱基编辑器(ABE)则可纠正约14.8%的错义突变,显示出两类碱基编辑器在纠正不同类型突变方面的互补性与广阔的应用空间。
为进一步提高碱基编辑系统对ABCA4突变位点的靶向能力,研究人员积极探索利用不同的PAM(前间隔序列邻近基序)变体,如Cas9-NGG、Cas9-NAG、Cas9-NGA以及xCas9等。这些PAM变体的引入显著扩展了碱基编辑的靶向范围,例如,仅Cas9-NGG即可靶向约76%的可纠正错义突变。在德国复合杂合患者队列中,91%的突变具有相关PAM位点,其中76%的突变具有不止一个PAM位点,这为个性化编辑策略的设计提供了更大的灵活性。通过结合不同的PAM变体,理论上可以将靶向效率提升至接近100%。在丹麦和中国队列中,分别有68%和76%的患者整体具有“理想”PAM位点,且约半数患者具有多个PAM位点,进一步验证了这种联合策略的可行性。
对于携带复杂等位基因的Stargardt病患者,即同一等位基因上存在多个致病突变的情况,多重编辑策略展现出显著优势。欧洲人群中复杂等位基因的发生率较高,总体约10%,其中德国队列中高达38%的患者至少有一个复杂等位基因。尽管复杂等位基因的存在使得可编辑转换突变患者的比例在德国队列中降至48%,但通过单次给药实现多重编辑(multiple editing),可以在同一PAM位点存在多个突变且可被同一种碱基编辑器纠正的情况下,同时纠正多个突变,从而扩大治疗的患者基础并可能提高治疗效果。例如,在食蟹猴胚胎中,使用SaKKH-CBE和ABE多重靶向EMX1、FANCF和BRCA1基因时,5/8的胚胎在所有三个位点都得到编辑,C>T转换的编辑效率为47%-100%,A>G转换的编辑效率为10%-86%。尽管同时递送两种碱基编辑器在体内仍面临挑战,但这项研究为ABCA4基因突变的多重编辑提供了概念性验证,对于欧洲人群中高比例的复杂等位基因患者,多重编辑具有显著的治疗潜力。然而,多重编辑的效率和安全性,特别是在体内的表现,仍需进一步研究验证。
尽管碱基编辑在纠正点突变方面表现出色,但仍有特定类型的突变目前难以被现有碱基编辑系统直接纠正,例如大片段缺失/插入、复杂重排等。这些突变类型的根本原因在于碱基编辑技术主要依赖于DNA单碱基的定向转换,其作用机制无法有效处理较大规模的基因组结构变异。针对这些难点突变,新兴技术如Prime Editing和RNA编辑提供了潜在的解决方案。Prime Editing通过逆转录酶介导的RNA模板指导的DNA合成,理论上能够实现所有12种单碱基转换以及小片段的插入和缺失,有望克服碱基编辑的局限性。RNA编辑则在RNA层面进行纠正,避免了对基因组DNA的永久性修饰,可能在可逆性和安全性方面具有优势。
在比较不同碱基编辑研究时,编辑效率、特异性以及长期稳定性是评估其临床转化潜力的关键指标。现有研究中,编辑效率因靶点、编辑系统类型(ABE或CBE)、PAM变体以及递送方式的不同而存在差异。特异性是确保脱靶效应最小化的重要考量,脱靶编辑可能导致非预期的基因组改变,进而引发潜在的安全风险。长期稳定性则关系到治疗效果的持久性,基因编辑的长期安全性及其在分裂细胞中的稳定性是未来临床试验设计中必须深入评估的关键问题。这些差异可能源于所用Cas9酶的活性、碱基编辑器的工程化改进、gRNA设计优化、递送系统的效率以及目标细胞类型等因素。未来的临床试验设计应充分考虑这些因素,例如优化递送载体以提高组织特异性和细胞内递送效率,并对脱靶效应进行全面而严谨的评估。
综合评估不同碱基编辑策略(如单次编辑、多重编辑、Prime Editing)在遗传性视网膜病治疗中的整体潜力,可以发现每种策略都有其适用突变谱和优劣势。单次碱基编辑适用于单一碱基转换引起的疾病;多重编辑则在纠正复杂等位基因或多个独立突变方面显示出前景,但在体内的递送和效率仍需深入研究;Prime Editing以其广泛的突变纠正能力,为难以通过传统碱基编辑纠正的突变提供了新的途径。然而,多重编辑的效率和安全性,以及Prime Editing的效率、特异性和安全性,特别是其在体内的表现,仍需进一步研究验证。未来研究应致力于进一步提高编辑效率和特异性,降低脱靶风险,并开发更安全高效的体内递送系统,以加速这些革命性技术向临床应用的转化。
3.1 Stargardt病ABCA4基因突变的可靶向性与编辑策略
Stargardt病(STGD1)作为一种常见的遗传性视网膜黄斑变性疾病,主要由ABCA4基因突变引起。碱基编辑技术因其高精度和特异性,在纠正这类单碱基突变方面展现出巨大的临床转化潜力。研究表明,在德国、丹麦和中国患者队列中,由碱基转换(C>T、G>A)引起的致病性ABCA4错义突变占据所有错义突变的32.7%至34.9%,这些突变原则上均可通过碱基编辑器进行纠正。具体而言,胞嘧啶碱基编辑器(CBE)能够纠正约17.9%的Stargardt病相关错义突变,而腺嘌呤碱基编辑器(ABE)则可纠正约14.8%的错义突变。
为了进一步提高碱基编辑系统对ABCA4突变位点的靶向能力,研究人员积极探索利用不同PAM(前间隔序列邻近基序)变体,例如Cas9-NGG、Cas9-NAG、Cas9-NGA和xCas9等。这些PAM变体的引入显著扩展了碱基编辑的靶向范围。例如,仅Cas9-NGG即可靶向约76%的可纠正错义突变。在德国复合杂合患者队列中,91%的突变具有相关PAM位点,其中76%的突变具有不止一个PAM位点。通过结合不同的PAM变体,理论上可以将靶向效率提升至接近100%。在丹麦和中国队列中,分别有68%和76%的患者整体具有“理想”PAM位点,且约半数患者具有多个PAM位点,这为个性化编辑策略的设计提供了更大的灵活性。
对于携带复杂等位基因的Stargardt病患者,即同一等位基因上存在多个致病突变的情况,多重编辑策略展现出显著优势。欧洲人群中复杂等位基因的发生率较高,总体约10%,其中德国队列中高达38%的患者至少有一个复杂等位基因。尽管复杂等位基因的存在使得可编辑转换突变患者的比例在德国队列中降至48%,但通过单次给药实现多重编辑(multiple editing),可以在同一PAM位点存在多个突变且可被同一种碱基编辑器纠正的情况下,同时纠正多个突变,从而扩大治疗的患者基础并可能提高治疗效果。例如,在食蟹猴胚胎中,使用SaKKH-CBE和ABE多重靶向EMX1、FANCF和BRCA1基因时,5/8的胚胎在所有三个位点都得到编辑,C>T转换的编辑效率为47%-100%,A>G转换的编辑效率为10%-86%。尽管同时递送两种碱基编辑器在体内仍面临挑战,但这项研究为ABCA4基因突变的多重编辑提供了概念性验证,对于欧洲人群中高比例的复杂等位基因患者,多重编辑具有显著的治疗潜力。然而,多重编辑的效率和安全性,特别是在体内的表现,仍需进一步研究验证。
尽管碱基编辑在纠正点突变方面表现出色,但仍有特定类型的突变目前难以被现有碱基编辑系统直接纠正,例如大片段缺失/插入、复杂重排等。这些突变类型的根本原因在于碱基编辑技术主要依赖于DNA单碱基的定向转换,其作用机制无法有效处理较大规模的基因组结构变异。针对这些难点突变,新兴技术如Prime Editing和RNA编辑提供了潜在的解决方案。Prime Editing通过逆转录酶介导的RNA模板指导的DNA合成,理论上能够实现所有12种单碱基转换以及小片段的插入和缺失,有望克服碱基编辑的局限性。RNA编辑则在RNA层面进行纠正,避免了对基因组DNA的永久性修饰,可能在可逆性和安全性方面具有优势。
在比较不同碱基编辑研究时,编辑效率、特异性以及长期稳定性是评估其临床转化潜力的关键指标。现有研究中,编辑效率因靶点、编辑系统类型(ABE或CBE)、PAM变体以及递送方式的不同而存在差异。特异性是确保脱靶效应最小化的重要考量,脱靶编辑可能导致非预期的基因组改变,进而引发潜在的安全风险。长期稳定性则关系到治疗效果的持久性,基因编辑的长期安全性及其在分裂细胞中的稳定性是未来临床试验设计中必须深入评估的关键问题。这些差异可能源于所用Cas9酶的活性、碱基编辑器的工程化改进、gRNA设计优化、递送系统的效率以及目标细胞类型等因素。未来的临床试验设计应充分考虑这些因素,例如优化递送载体以提高组织特异性和细胞内递送效率,并对脱靶效应进行全面而严谨的评估。
综合评估不同碱基编辑策略(如单次编辑、双重编辑、Prime Editing)在遗传性视网膜病治疗中的整体潜力,可以发现每种策略都有其适用突变谱和优劣势。单次碱基编辑适用于单一碱基转换引起的疾病;双重编辑或多重编辑则在纠正复杂等位基因或多个独立突变方面显示出前景,但在体内的递送和效率仍需深入研究;Prime Editing以其广泛的突变纠正能力,为难以通过传统碱基编辑纠正的突变提供了新的途径。未来研究应致力于进一步提高编辑效率和特异性,降低脱靶风险,并开发更安全高效的体内递送系统,以加速这些革命性技术向临床应用的转化。
3.2 其他遗传性视网膜病的碱基编辑探索与挑战
碱基编辑技术在遗传性视网膜疾病(IRDs)治疗中展现出广阔的应用前景,尤其是在纠正单碱基突变方面具有普适性 。针对Stargardt病,虽然文章重点聚焦于ABCA4基因的碱基编辑策略 ,但其原理可推广至其他IRDs。在莱伯先天性黑蒙(LCA)的治疗探索中,碱基编辑技术在CEP290基因的剪接位点突变(IVS26变体)纠正方面取得了进展 。CRISPR-SKIP策略被开发用于纠正此类剪接错误,通过在突变位点引入小片段插入来恢复正常的信使RNA剪接,进而恢复功能性蛋白表达,这在体外和动物模型中已显示出潜力 。对于USH2A基因突变,尽管目前尚未提及碱基编辑的直接应用案例,但鉴于其在视网膜色素变性(RP)和Usher综合征中的致病性,该基因被认为是基因治疗的重要靶点 。
在递送策略方面,腺相关病毒(AAV)载体因其低免疫原性和对视网膜细胞的良好感染效率,成为眼科基因治疗中最常用的体内递送工具 。不同的AAV血清型展现出细胞特异性:AAV2血清型对神经节细胞和Müller细胞具有亲和力,而AAV8血清型则能有效转导光感受器细胞和RPE细胞 。例如,针对RPE65基因突变的LCA治疗,AAV2-hRPE65载体已进入临床试验 。然而,AAV载体的容量限制(通常小于4.7 kb)对于递送大型基因(如ABCA4或USH2A)构成挑战,促使研究人员探索双载体策略以克服此限制 。此外,非病毒递送系统,如脂质纳米颗粒(LNPs),也正在开发中,以期克服AAV的容量和免疫原性限制,但其在视网膜中的递送效率和特异性仍需进一步优化 。
体内和体外研究结果的差异是碱基编辑技术转化面临的一大挑战。复杂的体内生物环境可能影响编辑效率和安全性,导致从体外模型到体内模型的转化仍面临诸多不确定性 。这包括动物模型选择的局限性以及脱靶风险评估的复杂性。在未来研究中,Prime Editing技术被认为具有处理更广泛突变谱的潜力,有望克服现有碱基编辑在处理复杂突变时的局限性。然而,该技术仍处于早期发展阶段,其在眼科基因治疗中的效率、特异性和安全性尚需进一步评估。
4. 临床转化之路:挑战、解决方案与前瞻性展望
遗传性视网膜病严重影响患者视功能与生活质量,CRISPR碱基编辑技术作为一种精准的基因编辑工具,为这类疾病的治疗带来了突破性的希望。然而,在将其从实验室研究推向临床应用的过程中,仍面临一系列复杂而严峻的挑战,包括核心技术瓶颈、递送策略限制以及潜在的安全性风险等。本章旨在全面综述当前CRISPR碱基编辑技术在治疗遗传性视网膜病临床转化中面临的关键挑战,并系统性地分析其根本原因。我们将深入探讨脱靶效应、递送效率与特异性、免疫原性、编辑效率以及PAM位点限制等核心障碍,为后续章节中提出的创新性解决方案和未来研究方向奠定基础。这些挑战的克服,将是CRISPR碱基编辑疗法成功实现临床转化的关键,从而为全球数百万遗传性视网膜病患者带来切实的治疗益处。
4.1 核心技术瓶颈与潜在风险的系统分析
CRISPR碱基编辑技术在治疗遗传性视网膜病方面展现出巨大潜力,然而其临床转化仍面临多重核心技术瓶颈与潜在风险,亟待学术界和产业界共同解决。
首先,脱靶效应是碱基编辑技术最主要的安全性隐患之一。尽管碱基编辑器被设计用于避免DNA双链断裂(DSB),但仍可能在基因组的非靶向位点引发不必要的碱基转换,包括DNA脱靶和RNA脱靶 。脱靶效应的产生不仅源于靶序列与非靶序列之间的相似性,更深层次的原因可能涉及Cas蛋白的结构特性、gRNA的设计限制以及细胞内DNA修复机制的复杂性。值得关注的是,“旁观者编辑”(bystander editing)风险。这意味着在编辑窗口内,除了目标碱基外,其他非目标碱基也可能被脱氨酶意外编辑 。在ABCA4基因这种拥有约1200个已知致病变异的复杂基因中,旁观者编辑的风险尤为突出,可能导致新的致病突变或影响基因功能,从而对视网膜细胞的正常功能和安全性产生负面影响 。为解决此问题,一种策略是采用更窄的编辑窗口,但这会显著减少可靶向突变的数量,限制了技术的普适性 。目前虽有多种脱靶检测方法,如BE-DeepSeq、DISCOVERY、Digenome-seq、CIRC-seq以及全基因组测序(WGS),但这些方法各有局限性。例如,WGS成本高昂且难以检测低丰度脱靶事件,并且可能无法全面捕捉所有潜在的脱靶事件,尤其是在低丰度或复杂基因组区域,这限制了其在视网膜细胞中安全评估的全面性 。尽管Cas编辑器近年发展已显著降低脱靶率并保持了高效的靶向编辑,但全面且高灵敏度的脱靶检测方法仍需进一步完善 。
其次,递送效率和特异性是碱基编辑技术临床转化的关键瓶颈。腺相关病毒(AAV)载体是目前最常用的体内递送工具,但其载体容量有限(约4.7 kb),这限制了大型碱基编辑器(如ABE)的递送,因为Cas酶、脱氨酶和gRNA的组合尺寸较大,通常超出AAV的容量限制 。针对ABCA4基因等编码序列较大的靶基因,可能需要采用双AAV载体策略,即将碱基编辑器系统拆分为两个独立的AAV载体递送,以实现高效递送并快速改变所需引导RNA 。然而,双载体策略增加了递送的复杂性、重组成功率的不确定性以及潜在的免疫原性,其编辑效率和体内安全性仍需进一步验证 。此外,不同AAV血清型对视网膜不同细胞类型(如光感受器细胞、RPE细胞、神经节细胞和Müller细胞)的亲和力各异,需要选择最适合目标细胞的血清型,如AAV2和AAV8 。非病毒递送系统,如脂质纳米颗粒(LNPs),虽然具有更大的载荷容量和较低的免疫原性潜力,但在视网膜内的递送效率和细胞特异性仍处于早期阶段,有待提升 。
第三,免疫原性是基因治疗普遍面临的挑战,对于碱基编辑技术亦是如此。Cas蛋白和脱氨酶(如APOBEC1)多源于细菌,宿主对其可能存在预存免疫反应,或在反复给药后引发免疫反应 。这些免疫反应不仅可能导致细胞毒性,降低编辑效率,甚至引发炎症,从而影响治疗效果和临床转化,限制了基因编辑的长期安全性和重复给药的可能性 。
第四,编辑效率不足,尤其是在体内环境下,碱基编辑效率可能远低于体外实验结果,这直接影响治疗效果。低编辑效率的根本原因可能包括递送效率受限、细胞内编辑机制的复杂性以及不同目标细胞类型对编辑工具的敏感性差异等 。
最后,PAM位点限制仍然是影响碱基编辑技术普适性的一个显著挑战。Cas蛋白对PAM序列(Protospacer Adjacent Motif)的严格要求,意味着并非所有致病突变位点都邻近合适的PAM序列,从而限制了碱基编辑工具的靶向范围 。尽管已有多种PAM变体(如NGG、NAG、NGA、SpCas9-NG、xCas9)被开发出来以拓宽靶向范围,但仍不能实现对所有碱基的靶向纠正 。对于拥有大量致病突变(如ABCA4基因的约1200个突变)的基因,针对每个突变测试多个引导RNA设计以优化编辑效率,仍是一项限制性工作,即使某些常见突变(如c.5882G>A)能够覆盖相当大的患者群体 。
综上所述,碱基编辑技术在临床转化过程中面临脱靶效应(特别是旁观者编辑)、递送载体限制、免疫原性、编辑效率不足以及PAM位点限制等多重关键挑战。这些挑战的根本原因在于Cas蛋白的结构特性、gRNA的设计局限性、细胞内DNA修复机制的复杂性、AAV载体固有的容量限制、Cas蛋白的外源性以及宿主免疫系统的复杂性。这些问题共同阻碍了技术的临床应用,亟需通过更精准的编辑工具开发、新型高效安全的递送策略、免疫原性最小化的设计以及更全面的脱靶检测方法等跨学科研究来解决。
4.2 未来研究方向与创新性解决方案
遗传性视网膜病的碱基编辑治疗展现出广阔前景,但其广泛临床应用仍面临诸多挑战。未来的研究将重点聚焦于开发新型编辑工具、优化基因递送系统、提高脱靶检测精度以及加速临床转化,并强调跨学科合作的重要性,以应对现有技术瓶颈并探索创新性解决方案。
1. 新型碱基编辑器的开发与应用
为克服当前碱基编辑的局限性,如PAM位点限制、旁观者编辑以及编辑范围窄等问题,新型碱基编辑器的开发至关重要。Prime Editing (PE) 技术被视为下一代基因编辑工具,其通过逆转录酶和含有逆转录模板的引导RNA(pegRNA),能够实现所有12种单碱基转换以及小片段的插入/缺失,而无需依赖DNA双链断裂(DSB)或同源重组,极大地扩展了可纠正突变的范围并降低了脱靶风险。最新一代PE3系统已显示出高达33%的靶向编辑效率并降低了脱靶效应,尽管体内验证仍需更多优化和研究。
此外,糖基化酶碱基编辑器(GBEs)的开发为纠正C>G和G>C等现有ABE或CBE难以纠正的突变提供了新途径,弥补了现有技术的局限性,并展现出5.3%至53%的高特异性靶向编辑效率。RNA碱基编辑系统,例如基于ADAR酶的RESCUE系统,具有可逆性和PAM无关性的优势,为视网膜疾病治疗提供了潜在的更安全选择,其编辑效率在人体细胞中可达60-80%,且非特异性结合和脱靶效应较低,但仍处于早期研究阶段,在视网膜中的效果尚不明确。
为解决腺相关病毒(AAV)载体容量限制问题,研究人员正积极探索更小型的Cas酶,如CasMINI(约3 kb)和CasΦ,以及CRISPR祖先IscB蛋白。这些紧凑型核酸酶与碱基脱氨酶融合后可形成更小的碱基编辑器,从而更容易被AAV载体递送,有望提高递送效率并拓展靶向范围。然而,这些新型Cas系统仍需在体内进行大量优化和阐明。
未来的研究应探索将传统CRISPR/Cas9的基因敲除/片段切除策略与新型碱基编辑(BE)和先导编辑(PE)技术相结合,形成一个“多模态基因编辑工具箱”。例如,对于需要大片段删除或基因沉默的常染色体显性遗传病,可采用CRISPR/Cas9介导的基因敲除;对于单碱基点突变,则优先考虑BE或PE。可探讨如何将多种编辑工具通过工程化的单个AAV载体递送,以实现更灵活、更精准的基因修复,这需要进一步优化AAV载体的载量和多基因表达能力,例如通过trans-splicing或intein-mediated protein splicing技术来克服AAV的载量限制,使得大型编辑系统仍能被高效包装和表达。目前大部分研究使用SpCas9,但其较大的尺寸和特定的PAM限制了其应用。未来可专注于筛选和工程改造来自不同细菌的紧凑型Cas9同源物(如SaCas9、CjCas9),以适应AAV的载量限制,并拓宽PAM识别范围。此外,可设计视网膜细胞特异性启动子来控制Cas9的表达,例如rhodopsin promoter(针对视杆细胞)或CRX promoter(针对光感受器细胞),确保编辑只发生在目标细胞类型中,进一步提高特异性并降低脱靶风险。
2. 基因递送系统的优化
高效、特异且安全的基因递送是碱基编辑技术应用于视网膜疾病治疗的关键。未来研究应着力于开发新型AAV衣壳,通过工程化AAV载体(如AAV-PHP.eB、AAV-PHP.S)以提高视网膜特异性、感染效率和降低免疫原性。同时,非病毒递送系统,如脂质纳米颗粒(LNPs)和聚合物纳米颗粒,因其低免疫原性、可重复给药和更大的载体容量潜力而备受关注,有望成为AAV的替代或补充,但其在视网膜中的递送效率和细胞特异性仍需提升。
3. 精确的脱靶检测与体内监测策略
为确保基因编辑疗法的安全性,发展更精确、更敏感的脱靶检测方法和体内监测技术至关重要。未来研究应开发基于长读长测序的高通量全基因组脱靶检测方法,以全面评估基因编辑的安全性。结合机器学习和人工智能技术,开发能够预测碱基编辑脱靶效应的计算模型,通过整合序列上下文、染色质可及性、Cas蛋白活性等多种生物信息学数据,提高预测的准确性。同时,发展高通量、单细胞水平的体内脱靶验证技术,如single-cell multi-omics sequencing,以全面评估基因编辑的安全性和有效性。此外,结合视网膜成像技术(如OCT、眼底自发荧光),实现对视网膜内编辑效果和细胞功能变化的实时、非侵入性监测,并采用单细胞测序评估基因编辑对不同视网膜细胞类型的影响及免疫反应,为个体化治疗提供指导。
4. 加速临床转化与伦理考量
加速碱基编辑技术从实验室到临床的转化是未来研究的重要目标。这包括优化临床试验设计、开发早期生物标志物、并建立标准化评估体系。借鉴其他基因治疗领域(如肝脏疾病、血液疾病)在伦理和监管方面的经验,对遗传性视网膜病治疗中可能引发的germline editing风险进行具体分析,并探讨如何建立健全的监管框架和伦理委员会来指导临床试验和应用。同时,讨论如何确保治疗的公平性,尤其是在罕见病高昂治疗费用背景下,以及如何提升公众对基因编辑疗法的认知和接受度,为未来的广泛临床应用奠定社会基础。
5. 跨学科合作的重要性
推动碱基编辑技术在遗传性视网膜病治疗领域的全面应用和突破性进展,离不开跨学科的紧密合作。基因组学、生物工程、材料科学、人工智能、眼科学和临床医学等领域的协同,将有助于整合基础研究与临床转化,加速创新性解决方案的开发与实施。此外,探索将基因编辑与细胞移植疗法相结合,以弥补基因编辑无法完全修复的严重结构损伤,也为未来的治疗策略提供了新思路。
5. 结论
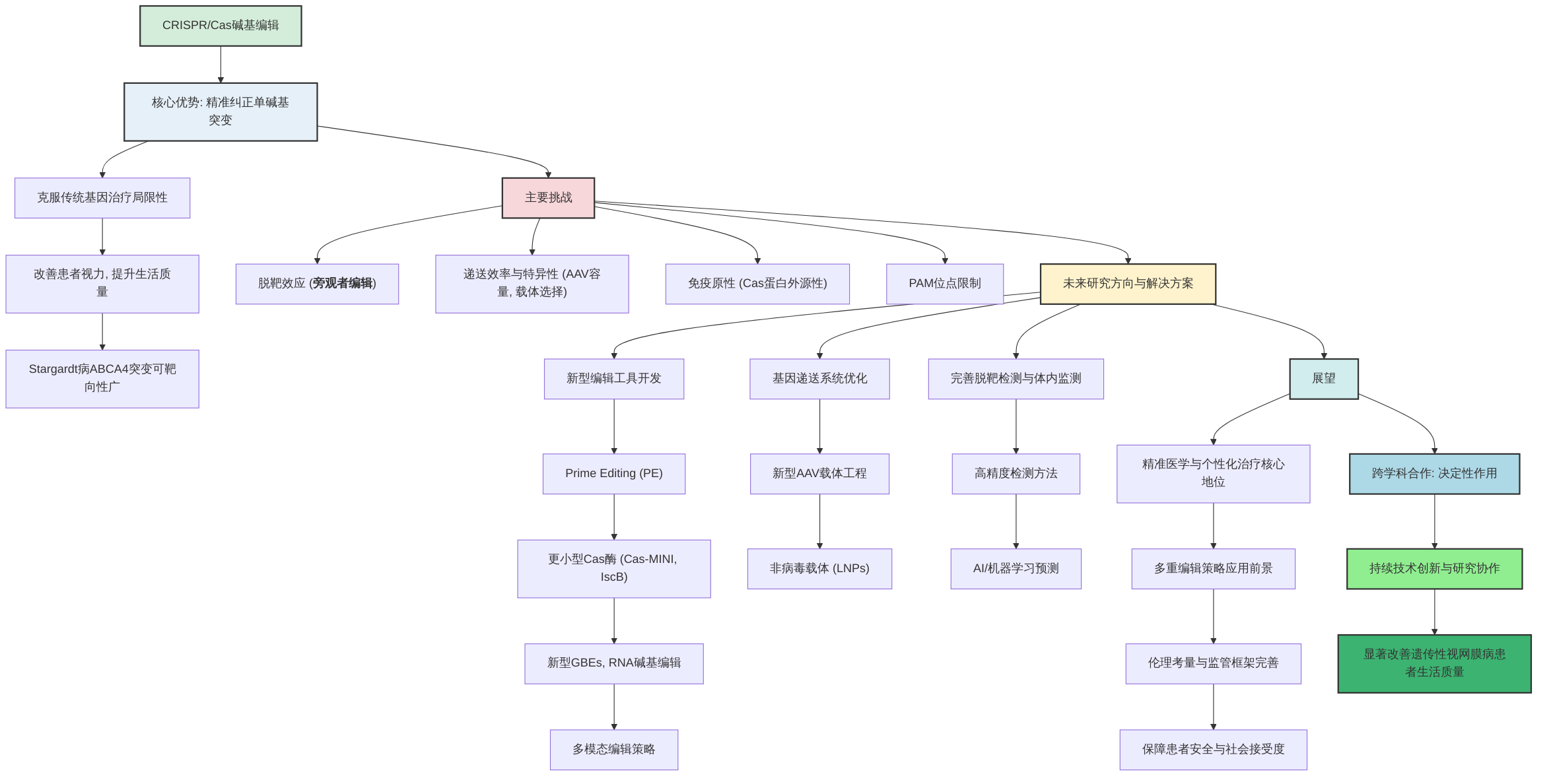
CRISPR/Cas系统,特别是碱基编辑技术,为遗传性视网膜病的治疗带来了革命性的希望,有望克服传统基因治疗的局限性,尤其是在精准纠正单碱基突变方面,从而从根本上改善患者视力并提升生活质量 。例如,针对Stargardt病的系统性综述表明,大多数致病性ABCA4转换突变都具有可靶向的PAM位点,这为碱基编辑提供了广阔的治疗机会 。
尽管前景广阔,该技术在临床转化中仍面临多重挑战,主要包括脱靶效应、递送效率与特异性、免疫原性以及PAM位点限制 。为克服这些瓶颈,未来的研究方向应聚焦于以下几个关键领域:首先,开发更安全、高效、特异的新型编辑工具,如Prime Editing、更小型的Cas酶(如Cas-MINI、IscB蛋白)以及新型的鸟嘌呤碱基编辑器(GBEs)和RNA碱基编辑工具,以扩大可靶向的突变谱并减少旁观者编辑效应 。其次,优化基因递送系统至关重要,包括开发新型腺相关病毒(AAV)载体和非病毒载体(如脂质纳米颗粒,LNPs),以提高靶向性和递送效率 。此外,建立更完善、更精确的脱靶检测和体内监测方法是保障治疗长期安全性的关键 。
展望未来,随着这些新兴技术的体内验证和优化,CRISPR碱基编辑技术有望在精准医学和个性化治疗中占据核心地位,通过多重编辑策略的应用,实现对遗传性视网膜病的精准、安全和高效治疗 。同时,基因编辑技术的伦理考量和监管框架也需不断完善,以确保其负责任的应用,特别是要严格控制脱靶效应以保障患者安全,并深入探讨其社会接受度 。
最终,跨学科合作在推动CRISPR碱基编辑技术临床转化中的作用是决定性的,通过持续的技术创新和研究协作,有望显著改善遗传性视网膜病患者的生活质量 。
References
In Vivo Applications of CRISPR-Based Genome Editing in the Retina - Frontiers https://www.frontiersin.org/journals/cell-and-developmental-biology/articles/10.3389/fcell.2018.00053/full
The Scope of Pathogenic ABCA4 Mutations Targetable by CRISPR DNA Base Editing Systems—A Systematic Review - Frontiers https://www.frontiersin.org/journals/genetics/articles/10.3389/fgene.2021.814131/full
The application and progression of CRISPR/Cas9 technology in ophthalmological diseases - PubMed https://pubmed.ncbi.nlm.nih.gov/35915232/
CRISPR-dependent base editing as a therapeutic strategy for rare monogenic disorders https://www.frontiersin.org/journals/genome-editing/articles/10.3389/fgeed.2025.1553590/full
