0. mRNA 疫苗平台在新发传染病防控中的拓展应用综述
1. 引言:mRNA疫苗的变革性崛起与全球公共卫生新挑战
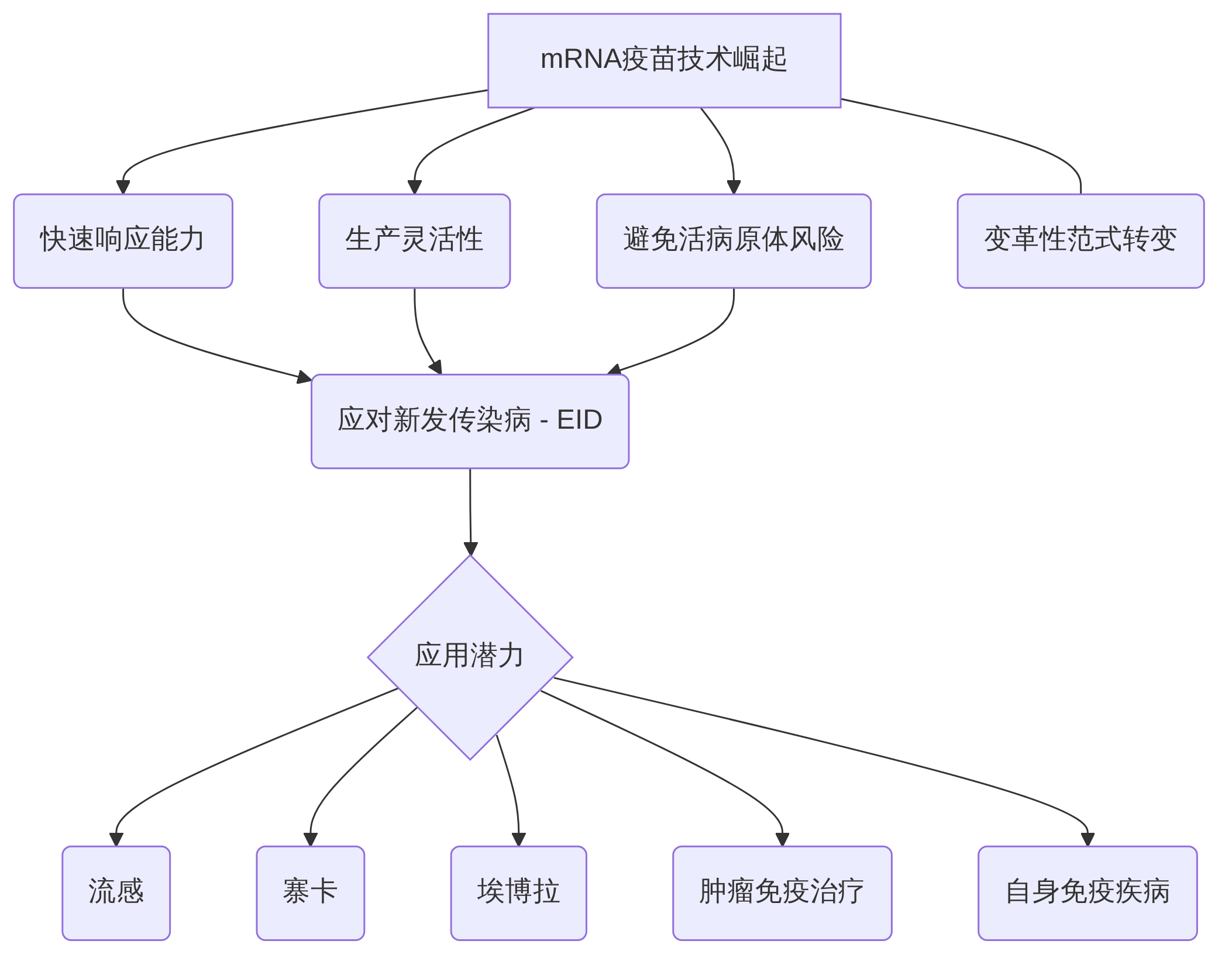
mRNA疫苗技术在近年来的快速崛起,尤其是在COVID-19大流行期间展现出的卓越性能,标志着疫苗学领域的一场革命性范式转变。与传统疫苗(如灭活、减毒活及亚单位疫苗)漫长且复杂的研发周期相比,mRNA疫苗的开发周期从数年缩短至数月,实现了前所未有的快速响应能力和生产灵活性。
其核心优势在于,mRNA疫苗通过合成mRNA编码靶抗原的遗传信息,并利用脂质纳米颗粒(LNP)进行递送,诱导宿主细胞直接产生特异性抗原,从而引发强大的体液和细胞免疫反应,并建立免疫记忆,同时规避了传统疫苗使用活的或减毒病原体的风险。这种独特的机制使其在应对全球公共卫生挑战方面展现出巨大潜力,特别是对于快速传播、高致病性且具有重大社会经济影响的新发传染病(EID),如SARS、MERS、埃博拉、寨卡等,mRNA疫苗的快速开发和部署能力显得尤为关键。
尽管mRNA疫苗在COVID-19大流行中(例如BNT162b2和mRNA-1273)已初步验证了其高效性和安全性,但对其安全性、免疫原性、反应原性及实际效果进行持续和全面的评估仍然是未来疫苗开发和公共卫生策略制定的重要前提。
展望未来,mRNA疫苗的应用前景远不止于COVID-19。除了在流感、寨卡、埃博拉、尼帕病毒、裂谷热病毒、巨细胞病毒(CMV)、带状疱疹病毒(VZV)等多种新发传染病领域展现出巨大潜力外,该平台在非传染病领域,尤其是肿瘤免疫治疗和自身免疫疾病治疗中也显示出广阔的应用前景。本综述将进一步深入探讨mRNA疫苗在应对新发传染病中的拓展应用,并分析其面临的挑战与未来发展方向。
2. mRNA疫苗平台:从分子设计到临床应用的核心优势与技术精进
mRNA疫苗作为一种革命性的免疫学工具,其在新发传染病防控中的作用日益凸显,这得益于其独特的核心技术原理和显著优势。本章将深入剖析mRNA疫苗的技术基础,包括其分子设计、递送系统、作用机制以及生产工艺,并探讨计算辅助设计在此领域的关键贡献,从而揭示其在快速响应新兴病原体方面的强大能力。
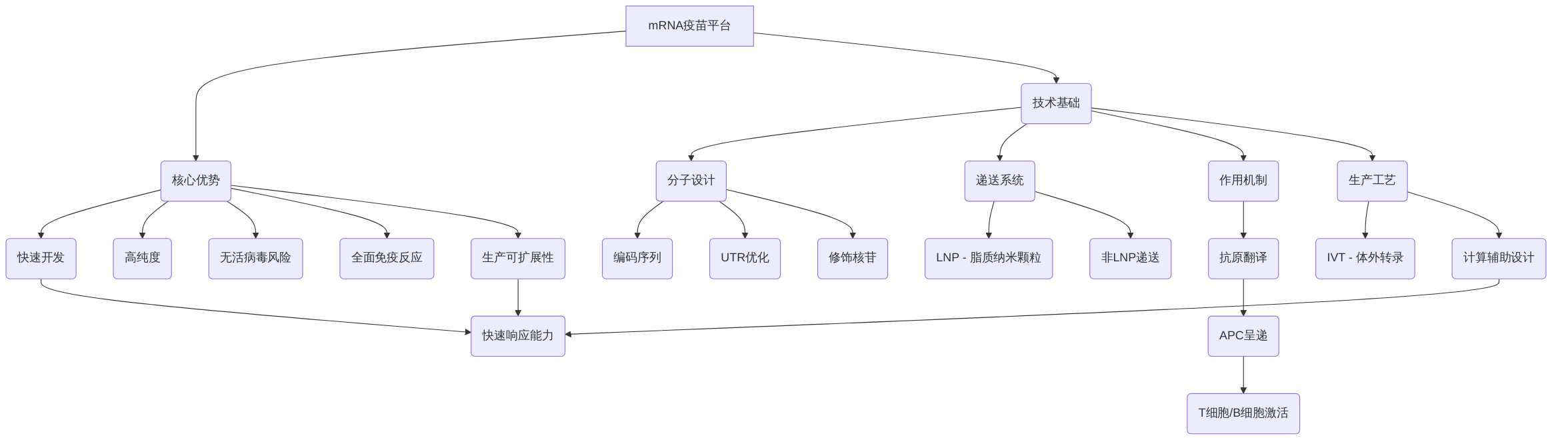
mRNA疫苗平台的核心优势在于其快速开发、高纯度、无活病毒风险、以及诱导全面的体液和细胞免疫反应,并具备卓越的生产可扩展性 。这些优势使得mRNA疫苗与传统疫苗(如鸡卵培养或减毒活疫苗)相比,在应对新发传染病爆发时展现出无与伦比的快速响应能力 。例如,COVID-19疫苗的快速开发和部署,从序列设计到紧急使用授权仅用了数月时间,充分证明了mRNA疫苗在疫情应急响应中的关键作用及其大规模生产潜力 。
mRNA疫苗平台的核心在于其体外转录(IVT)技术,该技术利用编码抗原蛋白的mRNA分子,经递送系统进入宿主细胞后,由宿主细胞的核糖体翻译产生抗原,从而诱导宿主免疫反应 。此过程模拟自然感染,但避免了活病原体带来的风险 。安全性方面,mRNA疫苗不整合到宿主基因组,且mRNA分子在体内降解迅速,显著降低了长期毒性风险 。
为了进一步提升mRNA疫苗的效力和安全性,计算辅助设计(in silico designs)发挥着越来越重要的作用。该技术在优化抗原设计、提高免疫覆盖率和有效性方面展现出巨大潜力 。通过精确预测和优化抗原表位,计算辅助设计能够提高疫苗诱导免疫反应的特异性和强度,从而更有效地应对复杂的病原体变异,例如在面对高度变异的病毒株时,可以快速调整疫苗设计以维持其保护效果。然而,当前计算模型在预测所有潜在病原体变异及其对免疫原性影响方面的准确性仍有待提高,尤其是在复杂多变的病原体进化压力下。未来的研究应致力于开发更先进的机器学习算法,以整合多组学数据,实现更精准的抗原表位预测和疫苗效力评估。
mRNA疫苗的作用机制涵盖了从分子递送、细胞内翻译到抗原呈递,最终激活全面的先天性和适应性免疫反应的完整过程 。mRNA分子通过脂质纳米颗粒(LNP)等递送系统进入宿主细胞,在细胞质中利用宿主核糖体翻译其编码的抗原蛋白 。LNP在保护mRNA免受降解和增强细胞递送方面具有关键作用 。随后,内源性表达的抗原被抗原呈递细胞(APCs)捕获并呈递,通过MHC-I途径激活CD8+细胞毒性T淋巴细胞,通过MHC-II途径激活CD4+辅助性T细胞,进而诱导B细胞产生特异性抗体,形成全面的体液免疫和细胞免疫应答 。
尽管mRNA疫苗在技术上取得了显著进展,但其在生产和分发方面仍面临挑战。特别是脂质纳米颗粒(LNP)对超低温储存的依赖性,给全球分发带来了物流和成本上的挑战。虽然自扩增RNA疫苗(Self-amplifying RNA vaccines)能够通过自我扩增提高抗原表达水平和免疫原性,但其生产和递送仍需进一步优化以克服现有瓶颈 。未来的研究将重点关注开发更稳定的递送系统,以减少对超低温储存的依赖,并提高疫苗在多样化环境下的可及性,同时探索更高效、低成本的生产工艺,以确保全球范围内的疫苗公平分配和快速响应能力。
2.1 mRNA疫苗的核心技术要素:分子设计与修饰
| 要素 | 策略 | 目的 |
|---|---|---|
| 修饰核苷 | 假尿苷 ()、N1-甲基假尿苷 (m1) 取代尿苷 | 降低免疫原性,延长半衰期,提高翻译效率与蛋白表达 |
| 5'帽结构 | 优化帽结构 | 提高翻译起始和效率,增强稳定性 |
| 3'Poly(A)尾 | 优化长度和完整性 | 提高翻译效率和mRNA稳定性 |
| 非翻译区 (UTR) | 来源于高表达基因的UTR序列工程化修饰 | 提高翻译效率、稳定性,实现亚细胞定位 |
| 密码子优化 | 调整同义密码子使用频率 | 提高蛋白质表达水平,增强抗原呈递效率和免疫应答 |
| 整体目标 | - | 提升效力、稳定性、安全性;实现快速、可控抗原表达和高效免疫反应 |
mRNA疫苗的成功研发及其在新发传染病防控中的广泛应用,核心在于其精密的分子设计与修饰策略,旨在显著提升疫苗的效力、稳定性和安全性。这些技术要素共同克服了早期mRNA疫苗的局限性,为实现快速、可控的抗原表达和高效免疫反应奠定了坚实基础。mRNA疫苗的设计理念可追溯至Jacob和Monod于1961年提出的核糖体通过mRNA翻译蛋白质的理论,当前主要通过体外转录(in vitro transcription)的无细胞过程制备。
在分子设计层面,关键的优化策略包括编码序列、非翻译区(UTR)的选择与精细调控,以及多种修饰技术的应用。修饰核苷的引入是提升mRNA疫苗性能的核心突破之一。例如,通过用假尿苷()和N1-甲基假尿苷(m1)取代常规尿苷,可以显著降低mRNA的免疫原性,减少宿主先天免疫系统的识别与激活,从而延长mRNA在体内的半衰期并提高翻译效率与蛋白质表达水平。相较于未修饰的mRNA,引入修饰核苷不仅降低了其内源性免疫刺激,避免了对翻译过程的抑制,还提升了mRNA的结构稳定性,使其在细胞内更有效地进行蛋白质合成。
除了核苷修饰,mRNA疫苗的结构元件优化同样至关重要。5'帽结构(cap structure)对mRNA的翻译起始、效率和稳定性具有决定性影响。优化帽结构可以提高核糖体对mRNA的识别和结合能力,进而增强翻译效率。同样,3'Poly(A)尾的长度和完整性也直接影响mRNA的稳定性和翻译效率。较长的Poly(A)尾通常与更高的翻译效率和更长的mRNA半衰期相关。
非翻译区(UTR)的工程化修饰也是提高mRNA翻译效率、稳定性和亚细胞定位的关键策略之一。研究表明,选择来源于高表达基因(如人-珠蛋白或-珠蛋白)的UTR序列可以显著增强mRNA的翻译效率。这些优化后的UTR能够有效调控核糖体募集、翻译起始和延长,从而提高抗原蛋白的表达水平。
此外,密码子优化技术通过调整编码序列中同义密码子的使用频率,使其更符合宿主细胞内tRNA的丰度分布,从而提高蛋白质的表达水平和抗原呈递效率,最终增强免疫应答强度。这些综合性的分子设计与修饰策略使得mRNA疫苗能够高效指导抗原在特定细胞区室的生产,随后被加工成表位并通过抗原呈递细胞(APC)表面的I类和II类主要组织相容性复合体(MHC)分子呈现,从而诱导强效的适应性免疫反应。
2.2 高效递送系统:脂质纳米颗粒(LNP)及新进展
| 递送系统 | 优势 | 局限性 | 应用场景 |
|---|---|---|---|
| 脂质纳米颗粒 (LNP) | 有效包裹保护mRNA,增强递送效率,促进内体逃逸;组分可调控 | 超低温储存要求高,物流成本高;潜在肝毒性;静脉注射限制 | SARS-CoV-2疫苗主流递送系统 |
| 肽基递送 | 可能具有更好的靶向性;为特定细胞或组织递送提供可能性 | 需进一步研究稳定性、可扩展性 | 靶向递送 |
| 阳离子纳米乳剂 (CNEs) | 有效递送mRNA并诱导强大免疫应答 | 稳定性和可扩展性需进一步研究 | - |
| 病毒样复制子颗粒 (VRPs) | 作为saRNA载体,显著提高抗原表达和免疫原性 | 可能存在预存免疫力问题,影响重复给药有效性 | 自扩增RNA递送 |
| 电穿孔技术 | 通过电脉冲直接递送至细胞内;局部递送有优势 | 通常局限于局部递送,不适用于全身性疫苗接种 | 树突状细胞(DC)疫苗 |
| 聚合物纳米颗粒 | 结构设计灵活,可调控mRNA释放动力学和靶向性 | 生物相容性和降解产物安全性需深入评估 | - |
mRNA疫苗的有效性关键在于其在人体内的精确递送,确保mRNA能顺利进入细胞质进行翻译,因为裸露的mRNA分子量较大且带负电荷,无法直接穿透细胞膜进入细胞核 。在此背景下,脂质纳米颗粒(LNP)已成为目前最成功且广泛应用的mRNA递送系统,并成功应用于SARS-CoV-2 mRNA疫苗的开发 。
LNP技术在提高mRNA疫苗效力和稳定性方面发挥着关键作用 。其优势体现在多个方面:首先,LNP能够有效包裹并保护mRNA免受核酸酶的降解,这对于维持mRNA的完整性和生物活性至关重要 。其次,LNP显著增强了mRNA向细胞的递送效率,促进细胞摄取并协助mRNA从内体逃逸,最终在细胞质中实现抗原的有效翻译 。其精确的组分设计是实现这些功能的基础,通常包括离子化脂质、胆固醇、磷脂和聚乙二醇脂质(PEGylated lipid) 。其中,离子化脂质在低pH环境下带正电,与带负电的mRNA形成复合物,而在生理pH下变为中性,有利于内体逃逸;胆固醇维持LNP的结构稳定性和促进膜融合;磷脂提供结构完整性;聚乙二醇脂质则能延长LNP在体内的循环时间并减少非特异性结合及免疫清除 。LNP的结构设计和组分优化对于控制mRNA的体内分布、细胞摄取效率和调控免疫原性至关重要 。
尽管LNP在mRNA递送中表现出色,但仍存在一定的局限性。例如,部分LNP需要超低温储存条件,这增加了疫苗分发和储存的物流复杂性与成本。此外,LNP可能存在潜在的肝毒性,以及静脉注射途径的限制,这可能不适用于所有疫苗应用场景。
为了克服LNP的这些局限性并实现更广泛的应用(如非静脉注射途径、靶向递送),新型递送系统正在积极探索中 。这些非LNP递送方法各有优缺点:
- 肽基递送:可能具有更好的靶向性,为特定细胞或组织递送mRNA提供了可能性 。
- 阳离子纳米乳剂(CNEs):能够形成胶束结构,有效递送mRNA并诱导强大的免疫应答 。然而,其稳定性和可扩展性仍需进一步研究 。
- 病毒样复制子颗粒(VRPs):作为自扩增RNA(saRNA)的一种递送载体,能够显著提高抗原表达水平和免疫原性 。但其主要挑战在于可能存在的预存免疫力问题,这可能影响其重复给药的有效性 。
- 电穿孔技术:通过电脉冲直接将mRNA递送至细胞内,在某些局部递送应用中具有优势,例如用于树突状细胞(DC)疫苗,但通常局限于局部递送,不适用于全身性疫苗接种 。
- 聚合物纳米颗粒:这类系统提供了灵活的结构设计,可以调控mRNA的释放动力学和靶向性,但其生物相容性和降解产物的安全性仍需深入评估 。
与LNP相比,这些新型递送系统在安全性、有效性、生产成本和储存条件等方面各有优劣。LNP在安全性方面已经积累了丰富的临床数据,特别是在SARS-CoV-2疫苗中的广泛应用证明了其整体安全性。然而,LNP的超低温储存要求以及潜在的肝毒性是其主要的不足。新型递送系统,如肽基递送和聚合物纳米颗粒,在某些情况下可能提供更温和的储存条件和更低的潜在毒性,并能实现非静脉注射,例如肌肉注射或皮内注射,从而提高疫苗的可及性和依从性。然而,这些新系统的有效性、大规模生产的可行性以及生产成本仍需进一步的临床验证和优化。未来的研究将致力于开发兼具LNP高效递送优势和新型系统更佳安全性、更低储存成本以及更广泛应用途径的综合性递送平台。
2.3 mRNA疫苗的作用机制与免疫应答
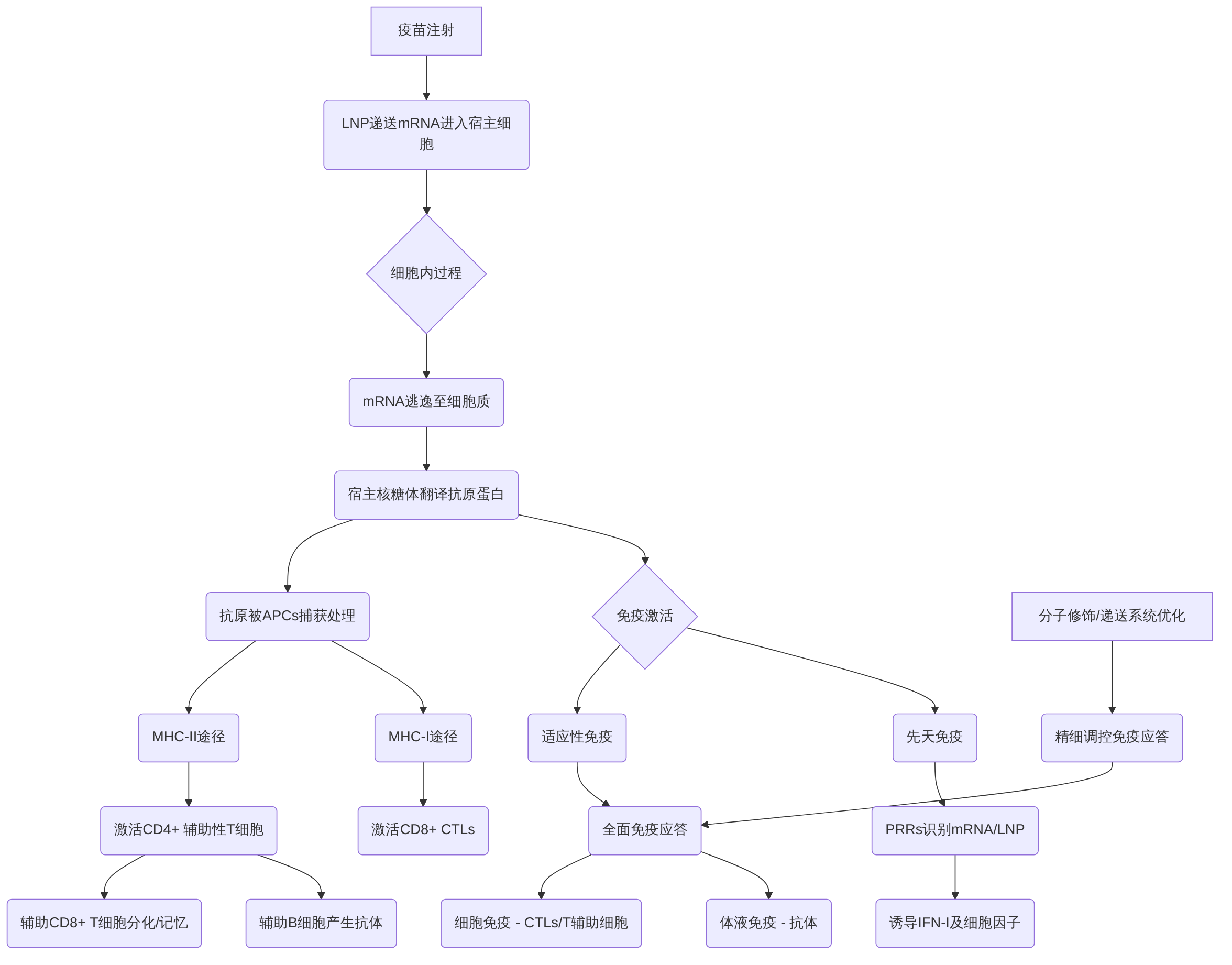
mRNA疫苗的作用机制是一个多阶段且高度协同的过程,它通过模拟自然感染,在不引入活的或减毒的病原体的情况下,有效激活宿主的先天性和适应性免疫反应。这一机制从mRNA递送、细胞内翻译,直至抗原呈递和全面的免疫激活,共同构建了其强大的保护性免疫应答。
疫苗注射后,mRNA通常通过脂质纳米颗粒(LNP)等递送系统进入宿主细胞,特别是抗原呈递细胞(APCs),如树突状细胞(DCs)和巨噬细胞。LNP在内体中通过离子化脂质的作用促进mRNA逃逸至细胞质,避免溶酶体降解。在细胞质中,mRNA利用宿主细胞的核糖体翻译其编码的抗原蛋白。这一翻译过程是mRNA疫苗作用机制的关键起点,确保了抗原蛋白的内源性表达。
mRNA疫苗在激活免疫应答方面,能够同时启动先天性和适应性免疫。首先,mRNA分子本身,特别是未修饰的mRNA,或LNP递送系统,可以被宿主细胞内的模式识别受体(PRRs)识别,例如Toll样受体(TLRs)如TLR3、TLR7、TLR8以及RNA解旋酶RIG-I和MDA5。这种识别迅速诱导I型干扰素(IFN-I)和其他细胞因子和趋化因子的产生,从而启动并增强先天免疫反应,为后续的适应性免疫提供关键的“危险信号”和炎症微环境。
在适应性免疫方面,内源性表达的抗原蛋白被APCs捕获并处理。这些抗原蛋白可以通过两条主要途径进行呈递。一方面,它们被蛋白酶体降解为肽段,并与主要组织相容性复合体I类(MHC-I)分子结合,呈递到细胞表面,从而激活CD8+细胞毒性T淋巴细胞(CTLs)。MHC-I途径的激活是mRNA疫苗的一个显著优势,因为它能够诱导高水平的细胞免疫,这是清除感染细胞或肿瘤细胞的关键机制。另一方面,抗原蛋白也可以通过内吞作用进入内体-溶酶体途径,降解为肽段后与MHC-II分子结合,呈递给CD4+辅助性T细胞。CD4+辅助性T细胞在免疫应答中发挥着核心作用,它们不仅帮助B细胞活化并产生高滴度特异性中和抗体,实现体液免疫,还能辅助CD8+ T细胞的分化和维持记忆免疫。APCs在这一过程中发挥关键作用,它们不仅呈递抗原,还能提供共刺激信号,指导T细胞向特定方向分化,影响免疫应答的类型和强度。
不同修饰和递送系统对免疫应答类型(如Th1 vs Th2)的影响至关重要。核苷修饰(如假尿苷或N1-甲基假尿苷)是优化mRNA疫苗性能的关键策略。这些修饰可以显著降低mRNA的免疫原性,减少先天免疫受体的识别,从而减少I型干扰素的产生,进而提高mRNA的翻译效率和抗原表达量,避免过度的炎症反应对适应性免疫的抑制。此外,密码子优化和非翻译区(UTR)的调控也可以影响mRNA的翻译效率、稳定性和抗原表达水平,从而精细调控免疫应答的类型和强度,以诱导更强的保护性免疫反应。例如,靶向递送mRNA或纳米颗粒至特定细胞,已被证明能够诱导强大的效应和记忆T淋巴细胞反应,并促进IFN-介导的晚期癌症清除,这表明精确的递送策略能够有效引导免疫应答方向,如偏向Th1型细胞免疫应答,这对于肿瘤免疫治疗尤为重要。
综上所述,mRNA疫苗通过其独特的机制,从细胞质内的抗原蛋白表达,到MHC I类和MHC II类分子介导的抗原呈递,再到先天性和适应性免疫的协同激活,有效地模拟了自然感染的免疫过程。通过分子修饰(如核苷修饰、密码子优化、UTR调控)和递送系统(如LNP)的协同作用,mRNA疫苗能够精细调控免疫应答的特异性、强度和持久性,从而实现对新发传染病及其他疾病的广谱保护。未来的研究将进一步聚焦于如何更精准地设计mRNA疫苗,以优化免疫应答类型,提升免疫记忆的持久性,从而应对更广泛的病原体威胁。
2.4 生产工艺与大规模可扩展性
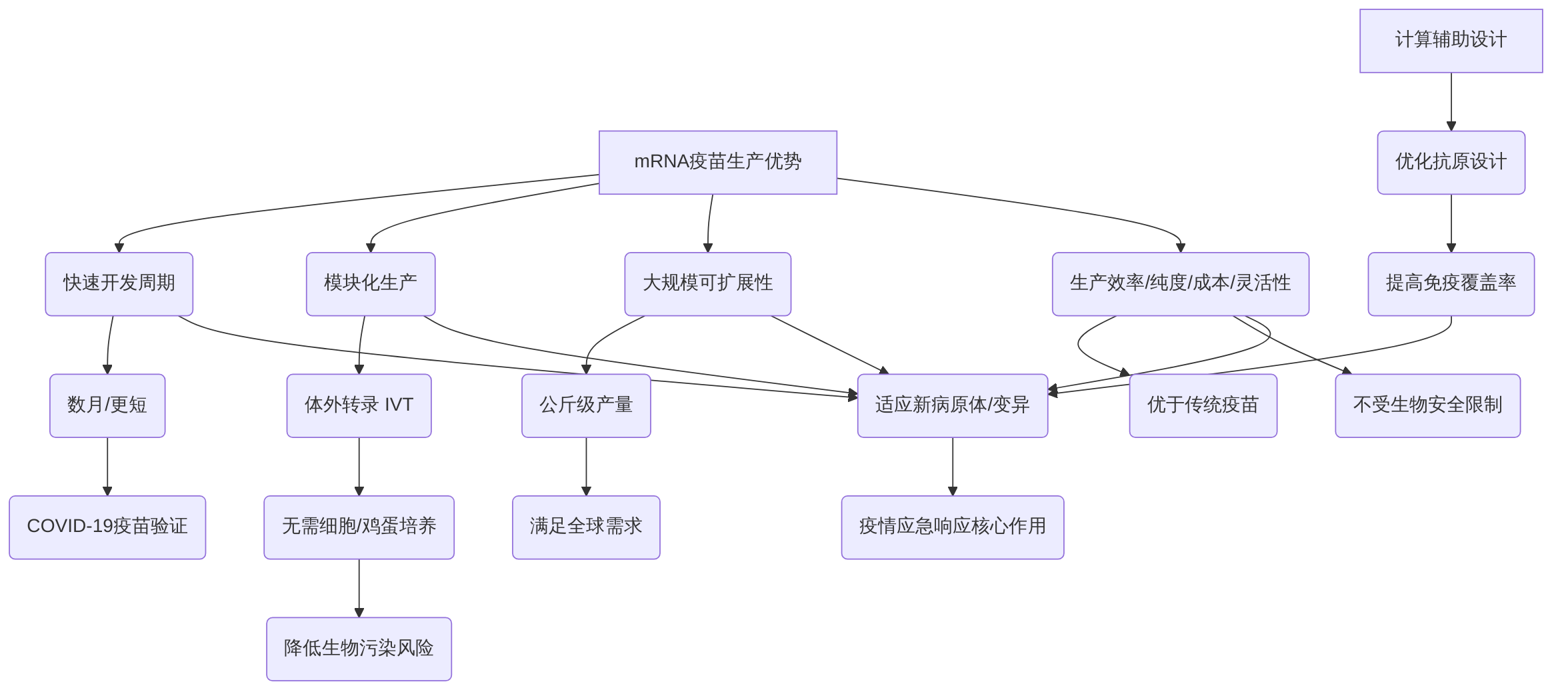
mRNA疫苗平台在应对新发传染病爆发时展现出独特的快速响应能力和显著的生产优势。其生产工艺的高度模块化和可扩展性是其核心竞争力。
在开发周期方面,mRNA疫苗极大地缩短了从靶抗原基因序列获取到临床试验的时间。相较于传统疫苗数年的开发周期,mRNA疫苗可将此时间压缩至数月甚至更短。例如,针对COVID-19的mRNA疫苗,从序列设计到获得紧急使用授权仅用了数月时间,这突显了其在疫情应急响应中的关键作用。这种快速响应能力主要得益于其模块化生产平台,该平台以体外转录(IVT)技术为核心,无需复杂的细胞培养或使用鸡蛋,简化了生产流程,同时降低了生物污染的风险。
mRNA疫苗的生产具有显著的大规模可扩展性,理论上可达到公斤级别的产量,从而满足全球范围内的疫苗需求。与传统疫苗技术(如鸡卵培养生产流感疫苗或减毒活疫苗)相比,mRNA疫苗在生产效率、纯度、成本和灵活性方面均显示出优势,且不受生物安全限制,使其在应对全球公共卫生危机时更具竞争力。
此外,计算辅助设计(in silico designs)在优化mRNA疫苗的抗原设计、提高免疫覆盖率和有效性方面展现出巨大潜力,进一步增强了其在疫情应急响应中的关键作用。例如,Maruggi等(2019)的研究讨论了mRNA疫苗如何能够快速适应新病原体。COVID-19疫苗(如BNT162b2和mRNA-1273)的快速开发和部署,有力证明了mRNA疫苗在大规模生产方面的潜力,并强调了其模块化设计在快速适应新兴病原体方面的优势。这些特点共同构成了mRNA疫苗作为通用性平台的底层逻辑,使其能够快速适应新出现的病原体变异,为疾病预防和控制提供了新的范式。
3. mRNA疫苗平台:新发传染病防控与通用性拓展
mRNA疫苗平台在应对全球公共卫生挑战方面展现出前所未有的潜力,其应用范围已从最初的COVID-19大流行,拓展至多种新发传染病、细菌性感染、寄生虫感染乃至非传染性疾病,如癌症、自身免疫病和遗传病。其核心优势在于快速响应能力、模块化生产流程以及强大的免疫原性,使其成为应对复杂病原体变异和多疾病威胁的通用性技术平台。本章将系统梳理mRNA疫苗平台在不同疾病防控中的拓展应用,重点分析其在多种病原体(特别是复杂寄生虫感染等)防控中的具体应用潜力,比较不同病原体疫苗设计中mRNA技术如何调整以适应其特异性免疫需求,并批判性评估其临床前和临床试验的初步结果。同时,结合其在快速响应方面的优势,深入分析mRNA平台在实现快速构建多价疫苗以应对变异株或多种病原体威胁方面的能力,并探讨其在非传染病领域的通用性拓展,特别是癌症免疫治疗的应用前景。
3.1 mRNA疫苗在病毒性疾病防控中的进展
| 病毒类型 | 抗原靶点 | 进展/优势 | 挑战/未来方向 |
|---|---|---|---|
| 流感病毒 | 血凝素 (HA) | 缩短上市时间,避免宿主适应性问题;计算辅助设计提升免疫覆盖 | 提供更广泛和持久保护 |
| 寨卡病毒 (ZIKV) | 前膜和包膜 (prM-E) 糖蛋白 | 临床前研究显示强大保护性免疫反应;对抗致死剂量感染 | 尚无获批疫苗/疗法,需推进临床试验 |
| 巨细胞病毒 (CMV) | 糖蛋白B (gB) 等抗原 | Moderna mRNA-1647进入临床试验,诱导强大免疫反应 | 预防新生儿出生缺陷希望 |
| 埃博拉病毒 | 病毒糖蛋白 (GP) | 动物模型高保护效力,进入临床试验 | 显示强大免疫原性和保护效果 |
| 带状疱疹病毒 (VZV) | 病毒糖蛋白gE等抗原 | BioNTech研发中,有望提供更强免疫反应 | 预防带状疱疹 |
| SARS-CoV-2 | 刺突 (S) 蛋白、S1亚基、RBD | 快速发展和应用,诱导T细胞和中和抗体;平台模块化设计快速适应变异株 | 持续有效性,应对变异株;多价疫苗/广谱保护 |
| 其他病毒 | HIV、尼帕病毒、裂谷热病毒等 | 广泛适用性,展现潜力 | 需更多临床前/临床试验 |
mRNA疫苗平台在多种病毒性疾病的防控中展现出显著的潜力和进展。其核心优势在于快速响应、灵活生产以及诱导强大免疫反应的能力,使其成为应对新发传染病和现有病毒威胁的重要工具。
1. mRNA疫苗在特定病毒防控中的应用进展
-
流感病毒(Influenza Virus):流感病毒以其抗原漂移特性导致疫苗需每年更新。mRNA流感疫苗通常靶向病毒表面的血凝素(HA)糖蛋白,HA是病毒进入细胞的关键介质。与传统基于鸡卵培养的疫苗相比,mRNA平台能够大幅缩短疫苗上市时间,避免宿主适应性引起的疫苗效力问题,并提供灵活的制造方案,结合计算机辅助设计以提升免疫覆盖率和有效性。Moderna公司正在研发的mRNA流感疫苗,有望提供比现有疫苗更广泛和持久的保护。
-
寨卡病毒(Zika Virus, ZIKV):寨卡病毒感染可导致吉兰-巴雷综合征和新生儿小头症等严重并发症,目前尚无获批疫苗或有效疗法。mRNA疫苗候选设计靶向ZIKV strain Brazil SPH2015的前膜和包膜(prM-E)糖蛋白,并封装于脂质纳米颗粒中。临床前研究显示,两次接种ZIKV prM-E mRNA-LNP疫苗能够诱导强大的保护性免疫反应,并对致死剂量的ZIKV感染提供保护。Moderna公司也开发了针对寨卡病毒的mRNA疫苗以应对其潜在的出生缺陷问题。
-
巨细胞病毒(Cytomegalovirus, CMV):CMV是一种常见的疱疹病毒,可导致新生儿出生缺陷。Moderna公司的mRNA-1647疫苗正在进行临床试验,其旨在编码病毒糖蛋白B(gB)等抗原以诱导保护性免疫反应。初步数据显示,该疫苗能够诱导强大的免疫反应,为预防CMV感染提供了希望。
-
埃博拉病毒(Ebola Virus):埃博拉病毒mRNA疫苗通过编码病毒糖蛋白(GP),在动物模型中展现出高度保护效力,并且已进入临床试验阶段,显示出强大的免疫原性和保护效果。
-
带状疱疹病毒(Varicella Zoster Virus, VZV):BioNTech正在研发一种mRNA疫苗,旨在通过编码病毒糖蛋白gE等抗原,提供比现有非mRNA疫苗更强的免疫反应,以更好地预防带状疱疹。
-
其他病毒:mRNA技术也被应用于HIV、尼帕病毒和裂谷热病毒等其他高致病性病毒的疫苗研发中,显示出其广泛的适用性。
2. mRNA平台在应对SARS-CoV-2变异株中的优势与挑战
COVID-19大流行极大地推动了mRNA疫苗的快速发展和应用。辉瑞-BioNTech的BNT162b2疫苗和Moderna的mRNA-1273疫苗是首批获得紧急使用授权的mRNA疫苗,它们主要编码SARS-CoV-2的刺突(S)蛋白、S1亚基或受体结合域(RBD)。这些疫苗能够诱导T细胞介导的免疫和强大的中和抗体反应。临床试验结果显示,BNT162b2疫苗在预防症状性COVID-19方面达到95%的有效性,而mRNA-1273疫苗的有效性为94.1%。
mRNA疫苗平台快速扩增生产的能力是其应对全球大流行的主要优势。其模块化设计有助于快速适应新兴病原体和病毒变异,为疫情爆发提供显著优势。例如,针对SARS-CoV-2的Delta和Omicron等变异株,mRNA平台能够通过引入新的抗原或保守抗原表位来快速调整疫苗设计,以提供更广泛的保护,从而解决传统疫苗每年更新的局限性。
3. 多价疫苗与广谱保护的探索
mRNA平台在实现快速构建多价疫苗以应对变异株或多种病原体威胁方面具有显著优势。通过结合多种抗原,mRNA技术有望开发出多价或广谱疫苗,例如应对不同流感病毒株或SARS-CoV-2变异株,从而简化疫苗接种流程并提高保护效率。这种策略通过编码保守抗原表位或多种抗原,能够诱导广泛的免疫应答,包括针对不同亚型的保护性抗体,从而实现更广泛的保护,例如通用流感疫苗和冠状病毒家族疫苗的开发。
4. 未来研究方向
尽管mRNA疫苗在病毒性疾病防控中取得了巨大成功,但仍需深入探索其对SARS-CoV-2等病毒变异株的持续有效性,以确保持续的公共卫生保护。未来的研究方向应包括:进一步优化抗原设计以增强广谱保护能力;探索新型递送系统以提高疫苗稳定性和免疫原性;以及开展更大规模、更长时间的临床试验,以全面评估多价或广谱mRNA疫苗的安全性、有效性和持久性。同时,针对不同病原体的特异性免疫需求,mRNA技术如何进一步调整以适应其独特挑战,也是未来研究的重要方向。
3.2 mRNA疫苗在细菌与寄生虫感染防控中的探索
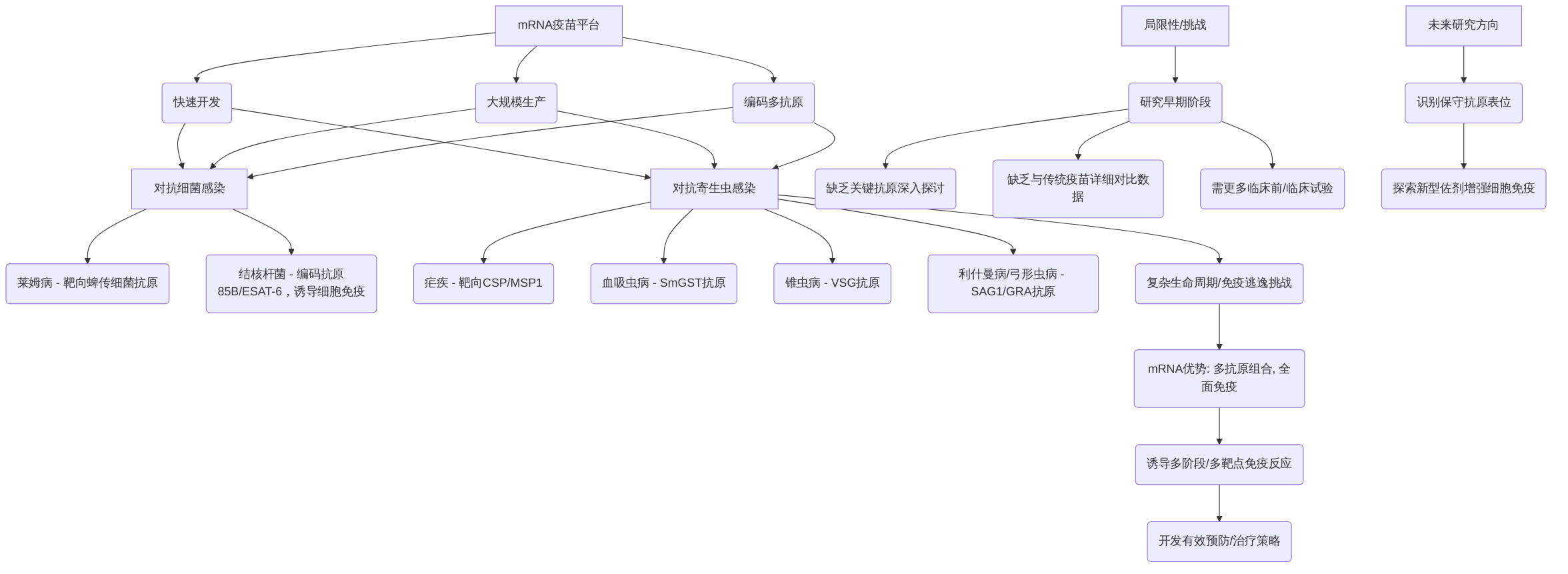
mRNA疫苗平台以其快速开发、大规模生产和编码多抗原的潜力,为对抗细菌和寄生虫感染提供了新的策略。在细菌感染方面,mRNA疫苗的研发已展现出前景。例如,针对莱姆病,目前正在开发靶向蜱传细菌特定抗原的mRNA疫苗,有望提供有效保护。此外,mRNA疫苗也被探索用于结核杆菌感染的防控,旨在通过编码抗原85B和ESAT-6等特定抗原,诱导强效的细胞免疫反应,这对于对抗结核杆菌的细胞内感染至关重要。
在寄生虫感染方面,mRNA疫苗平台同样展现出巨大的应用潜力,尤其是在应对土壤传播的蠕虫感染和人类动能虫原生动物感染等方面。针对疟疾,mRNA疫苗已在临床前研究中评估了靶向恶性疟原虫环子孢子蛋白(CSP)和裂殖子表面蛋白1(MSP1)的疫苗,这些抗原在阻断疟疾传播和减轻疾病方面发挥关键作用。此外,mRNA疫苗研发还涵盖了血吸虫病(如通过SmGST抗原)、锥虫病(如通过VSG抗原)、利什曼病和弓形虫病(如通过SAG1和GRA抗原)等多种寄生虫感染,旨在通过mRNA技术诱导针对复杂寄生虫关键抗原的免疫应答,以期开发出有效的预防和治疗策略。
mRNA疫苗相较于传统寄生虫疫苗,在快速响应能力、多抗原编码以及诱导全面免疫应答(包括体液免疫和细胞免疫)方面展现出显著优势。寄生虫复杂的生命周期和多样的免疫逃逸机制是疫苗研发面临的巨大挑战。然而,mRNA平台能够快速编码多个抗原或同一抗原的不同表位,有望开发出能够诱导多阶段、多靶点免疫反应的疫苗,例如针对疟原虫生命周期不同阶段的关键抗原组合疫苗。
尽管mRNA疫苗在对抗细菌和寄生虫感染方面展现出巨大潜力,但该领域的研究仍处于早期阶段。现有文献虽然提及了多种抗原选择,但缺乏对这些关键抗原选择依据及其在诱导保护性免疫反应中具体作用的深入探讨。此外,文章在批判性对比mRNA疫苗与传统寄生虫疫苗的优缺点方面,也未能提供详细的实验数据或更深入的机制分析。目前,仍需更多临床前和临床试验来验证其有效性和安全性,并分析当前研究的局限性。未来研究应着重于识别更广泛且保守的抗原表位,并探索结合新型佐剂以增强细胞免疫应答,以应对其复杂的免疫逃逸机制。
3.3 mRNA疫苗在非传染病领域的通用性拓展
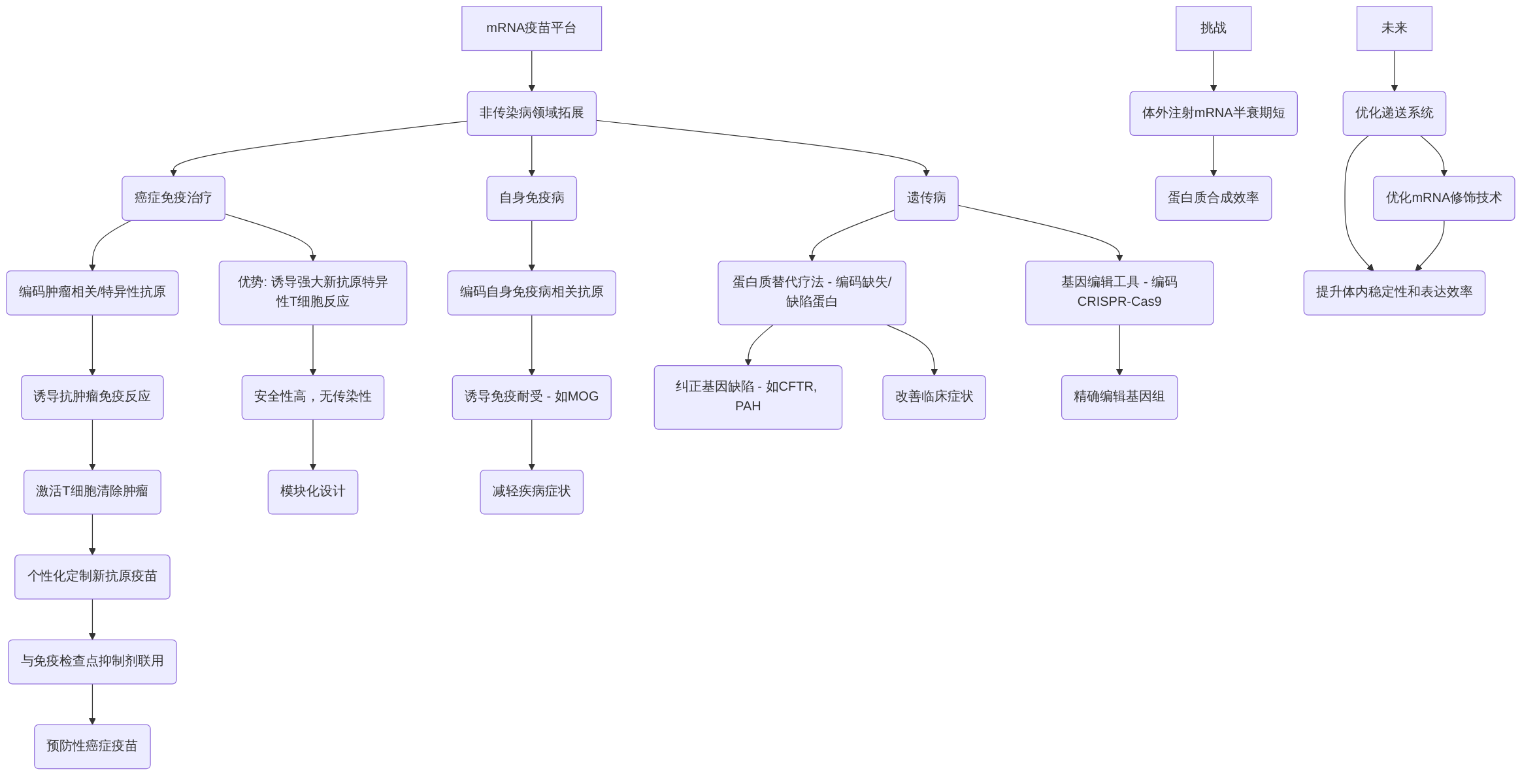
mRNA疫苗平台不仅在传染病预防中展现出卓越效能,其在非传染病领域,特别是癌症免疫治疗、自身免疫病和遗传病中的通用性拓展潜力也日益凸显,预示着全新的治疗范式。
在癌症免疫治疗中,mRNA疫苗通过编码肿瘤相关抗原(TAAs)或肿瘤特异性抗原(TSAs),旨在诱导特异性的抗肿瘤免疫反应,从而激活T细胞识别并清除肿瘤细胞。具体而言,这些抗原可以包括黑色素瘤相关抗原(MAGE)、NY-ESO-1、癌胚抗原(CEA)或突变KRAS蛋白等。相较于传统癌症治疗方法,mRNA疫苗的独特优势在于其能够诱导强大的新抗原特异性T细胞反应。通过个性化定制,mRNA疫苗可以编码患者肿瘤特有的新抗原,实现精准治疗,例如BioNTech和Moderna正在开发的个性化mRNA疫苗BNT122,已在黑色素瘤等癌症的临床试验中显示出积极结果。此外,mRNA疫苗能够直接在细胞质中翻译,避免了基因插入和/或感染引起的突变风险,安全性高且无传染性,且其模块化设计使其能够编码免疫调节分子和抗原分子,激活并调节先天性和适应性免疫反应。将全长肿瘤抗原加载到树突状细胞(DCs)上,可以诱导广泛的T细胞反应,不受患者HLA类型限制,有望改善免疫治疗效果。
在临床应用中,mRNA疫苗与免疫检查点抑制剂的联合应用前景广阔,有望进一步提高疗效。例如,针对KRAS突变蛋白的mRNA疫苗在胰腺癌和结直肠癌患者中已显示出激活免疫反应的潜力。除了治疗性癌症疫苗,mRNA技术还在探索预防性癌症疫苗,以阻止肿瘤的发生和发展,例如针对人乳头瘤病毒(HPV)引起的宫颈癌。然而,现有文献中对于mRNA技术在肿瘤免疫治疗中相较于传统方法的详细优势与局限性(例如具体的疗效差异、不良反应谱、长期免疫记忆等)的批判性分析仍有待深入,需要未来研究进一步补充。Dolgin (2021)虽然强调了mRNA技术在癌症治疗中的潜力,但未详细阐述其具体的免疫诱导机制和与其他免疫疗法的联合应用前景,这亦是当前文献的不足之处。
在自身免疫病和遗传病领域,mRNA平台展现出作为蛋白质替代疗法或基因编辑工具的独特潜力。对于自身免疫病,mRNA平台可以通过编码自身免疫病相关的抗原,诱导免疫耐受,例如在多发性硬化症模型中,通过编码髓鞘少突胶质细胞糖蛋白(MOG)诱导调节性T细胞,从而减轻疾病症状。在罕见遗传病中,mRNA可以作为蛋白质替代疗法,通过编码缺失或缺陷的蛋白质,以纠正基因缺陷导致的蛋白质表达异常。这包括治疗囊性纤维化(编码囊性纤维化跨膜传导调节因子CFTR)、苯丙酮尿症(编码苯丙氨酸羟化酶)以及镰状细胞贫血症等,从而改善患者的临床症状和生活质量。此外,mRNA技术在基因编辑领域亦有重要应用,例如通过编码CRISPR-Cas9系统中的Cas9核酸酶和引导RNA,实现对基因组的精确编辑,为遗传疾病的治疗提供了新的途径。这些初步研究成果强调了mRNA平台在这些领域为患者带来突破性治疗的希望。尽管如此,体外注射mRNA半衰期短以及随后的蛋白质合成效率仍是其面临的挑战,需要进一步优化递送系统和mRNA修饰技术来提升其体内稳定性和表达效率。
4. 挑战与机遇:mRNA疫苗平台的瓶颈突破与前沿方向
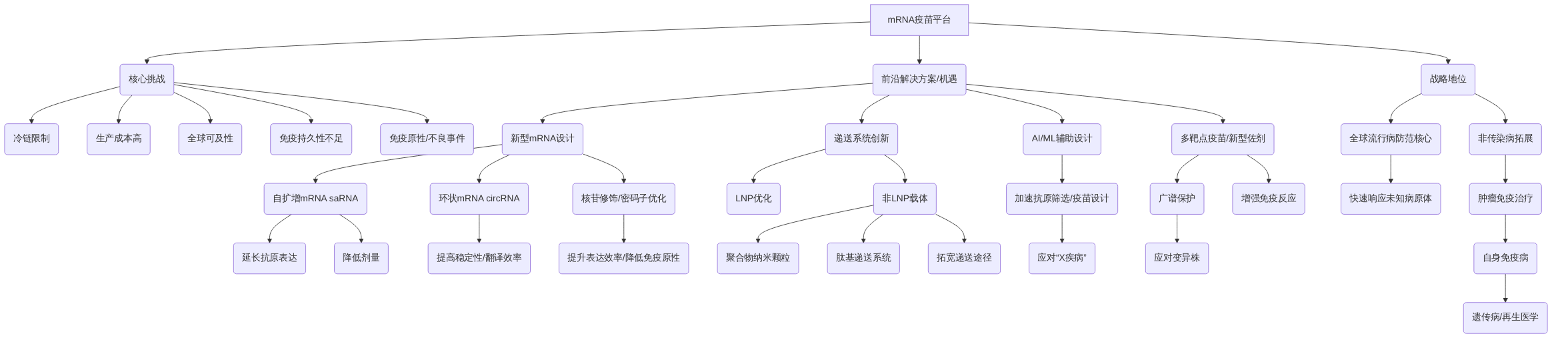
mRNA疫苗平台在应对新发传染病方面已展现出里程碑式的成就,为全球公共卫生带来了革命性的变革。然而,其广泛应用和未来发展仍面临多方面的挑战,这些挑战涵盖了技术、生产、物流以及社会伦理等多个维度。这些核心瓶颈包括冷链限制、高昂的生产成本、全球可及性问题、免疫持久性不足以及潜在的免疫原性与罕见不良事件。例如,当前主流mRNA疫苗对超低温储存的严格要求,使得在资源有限的地区推广面临巨大挑战,直接影响其全球公平分配的能力。此外,mRNA疫苗的生产工艺复杂,导致成本相对较高,加之其在体内抗原表达时间有限,可能影响长期免疫保护,从而需要更频繁的加强接种,进一步增加了成本和物流负担。尽管罕见,但如心肌炎等不良事件的出现,也提示我们需要持续监测并深入研究其潜在机制,以进一步提升疫苗的安全性。
面对这些挑战,当前研究正积极探索多维度的解决方案和技术创新,这些创新不仅旨在突破现有瓶颈,更将为mRNA疫苗平台开辟广阔的应用前景。其中,新型mRNA设计策略,如自扩增mRNA(saRNA)和环状mRNA(circRNA),通过增强mRNA的稳定性和翻译效率,有望显著降低疫苗剂量并延长抗原表达时间,从而提升免疫持久性并降低生产成本。同时,密码子优化和核苷修饰等技术改进,进一步提高了mRNA的体内表达效率并降低了其固有免疫原性。在递送系统方面,除了持续优化脂质纳米颗粒(LNP),研究人员还在积极探索非LNP载体,如聚合物纳米颗粒和肽基递送系统,以实现更精准的靶向性递送、更高效的内体逃逸和更低的副作用,甚至为口服或鼻腔递送提供了可能性。
除了对mRNA分子和递送系统的内在优化,人工智能(AI)和机器学习(ML)的引入,正在加速疫苗开发进程,尤其是在抗原筛选、表位预测和疫苗设计方面,极大地提升了效率与精准度。AI能够基于海量生物数据,快速识别最具免疫原性和保守性的抗原,从而加速针对新发病原体(如“X疾病”)的疫苗设计与开发,实现快速响应。此外,多靶点疫苗和新型佐剂的开发,为增强免疫反应、应对病原体变异和复杂感染提供了新的策略。多靶点疫苗可以同时编码多种抗原,以诱导更广谱的保护,而新型佐剂则可以精准调控宿主免疫应答,例如优化T细胞反应,以提高对细胞内病原体或肿瘤的清除效率。
从全球公共卫生的战略角度来看,mRNA疫苗平台在全球流行病防范体系中占据着不可替代的战略地位。其快速响应能力,特别是对未知病原体的快速适应性,使其成为未来全球健康危机应对的核心力量。更重要的是,mRNA技术的应用已不再局限于传染病领域,其在肿瘤免疫治疗、自身免疫病、罕见遗传病甚至再生医学等非传染病领域的拓展应用,预示着其巨大的战略意义和广阔的发展空间。这些跨领域的应用不仅体现了mRNA平台的多功能性,也为解决多种未满足的医疗需求提供了创新解决方案。
综上所述,本章将深入剖析mRNA疫苗平台在广泛应用中面临的核心挑战,并系统性地阐述现有技术如何提供解决方案,以及人工智能辅助设计、多靶点疫苗、新型佐剂等技术创新带来的机遇。同时,将突出mRNA平台在全球流行病防范体系中的战略地位,并延伸讨论其在非传染病领域的战略意义。本章旨在全面展现mRNA技术面临的共性问题与跨领域解决方案,并明确指出未来的研究方向,旨在提升疫苗效力、安全性、可及性和响应速度。
4.1 技术挑战与瓶颈突破
mRNA疫苗平台在为新发传染病提供快速响应方案的同时,其广泛应用仍面临多项关键技术挑战。这些挑战主要集中在mRNA的稳定性、递送效率、免疫原性、免疫持久性以及潜在的不良事件管理方面。
首先,mRNA分子本身极易受到核酸酶降解,导致其在体内的半衰期短,稳定性差,这要求其必须依赖高效的递送系统进行保护。尽管脂质纳米颗粒(LNP)已成为当前mRNA疫苗的主流递送载体,并在保护mRNA和促进细胞内递送方面展现出显著效果,但其靶向性、内体逃逸效率以及潜在的免疫原性仍有待优化。
其次,免疫持久性是mRNA疫苗面临的一项关键挑战,主要表现为疫苗接种后抗体滴度随时间下降以及记忆T细胞维持不足,这直接影响疫苗的长期保护效果。传统mRNA疫苗的抗原表达时间有限,且对宿主免疫系统的激活可能不够持续,是导致免疫持久性不足的根本原因。为应对这一挑战,研究人员正在积极探索新型mRNA设计策略,例如:
- 自扩增mRNA(saRNA):这类mRNA通过编码病毒复制蛋白,能够在体内自我扩增,从而实现抗原的持续表达。saRNA不仅有望有效延长免疫持久性,还能显著降低疫苗所需剂量,但其潜在的免疫原性风险仍需进一步评估。
- 环状mRNA(circRNA):circRNA因其独特的无末端结构,能够有效避免外切核酸酶的降解,从而显著提高mRNA的稳定性和翻译效率,有望进一步延长抗原表达时间并增强免疫持久性。
此外,优化mRNA修饰策略也对提高疫苗效力至关重要。通过开发新型核苷修饰(如假尿苷和N1-甲基假尿苷)以及进行密码子优化和非翻译区(UTR)工程,可以有效提高mRNA的稳定性、翻译效率并降低其固有免疫原性,从而延长抗原在体内的作用时间。
在递送系统方面,除了改进LNP,研究人员还在积极探索多种非LNP载体,如聚合物纳米颗粒、肽基递送、阳离子纳米乳剂、病毒样复制子颗粒以及电穿孔技术,这些技术旨在提高mRNA的细胞摄取效率和靶向性,减少脱靶效应,并拓宽递送途径(如口服或鼻腔递送),以提升患者依从性和疫苗的可及性。同时,新型佐剂的加入能够进一步增强免疫应答的强度和广度,特别是在诱导细胞免疫方面,为提升疫苗效力提供具体解决方案。
最后,尽管mRNA疫苗在安全性方面表现良好,多数情况下报告为轻度至中度反应原性,但罕见不良事件(如心肌炎、过敏反应)仍需持续关注并深入研究其深层机制。例如,Gargano等(2021)的调查表明,心肌炎病例虽然罕见,但在年轻男性接种第二剂疫苗后有所报告。Shimabukuro等(2021)审查的上市后安全监测数据也强调了严重过敏反应如过敏性休克的罕见性。因此,对这些不良事件的深入机制研究和风险管理是未来技术突破的关键,将进一步提升疫苗的安全性。这些技术创新共同为突破当前mRNA疫苗的瓶颈提供了巨大机遇,有望在提升疫苗效力、安全性和可及性方面取得显著进展。
4.2 生产与物流挑战及应对策略
mRNA疫苗在应对新发传染病方面展现出巨大潜力,然而,其在全球范围内的可及性和公平分配面临着显著的生产与物流挑战。这些挑战主要体现在高昂的生产成本、规模化生产的复杂性以及严格的冷链要求。例如,辉瑞/BioNTech的mRNA疫苗需要-70°C的超低温储存,这在资源有限的地区构成了严重的物流障碍。
为缓解上述限制,目前正积极探索多种应对策略。在生产方面,工艺优化是核心方向。采用连续流生产和模块化生产平台有助于提高生产效率,降低批次间差异,并最终削减生产成本。此外,降低生产成本的策略还包括优化原材料采购、提高体外转录(IVT)反应效率以及改进纯化工艺以减少损耗。自动化和集成化的生产流程能够进一步降低人力成本并提高产能,从而实现规模经济效益,摊薄单位成本。
在物流方面,新型储存和运输方案的开发至关重要。冻干(Lyophilization)制剂和热稳定制剂的研发旨在消除对超低温冷链的依赖,从而显著降低运输和储存成本,并扩大疫苗的全球可及性,尤其是在偏远或资源匮乏的地区。例如,开发能够在常规冰箱温度下长期储存的mRNA疫苗将是突破性的进展,直接提升全球疫苗公平分配的能力。
此外,分布式生产模型的潜力不容忽视。通过标准化、小型化设备,可以在不同区域灵活建立生产设施,提高生产灵活性和区域响应能力。这种模式不仅有助于应对突发疫情,还能降低对集中式大型生产设施的依赖,从而在更广阔的地理范围内实现疫苗的快速生产和分发。尽管mRNA疫苗生产具有模块化和快速可扩展性,能够达到公斤级产量且成本相对较低,但其大规模生产和全球分发仍需持续优化。未来的研究应聚焦于进一步简化生产流程、开发更具成本效益的原材料,以及完善常温储存技术,以确保mRNA疫苗平台在新发传染病防控中发挥最大潜力,实现真正的全球可及性。
4.3 社会与伦理挑战及政策思考
mRNA疫苗平台在应对新发传染病中展现出巨大潜力,然而,其广泛应用和公众接受度仍面临显著的社会与伦理挑战。这些挑战主要体现在疫苗犹豫、监管障碍和伦理考量三个方面。
首先,疫苗犹豫是影响mRNA疫苗推广的普遍问题。部分公众对新技术和疫苗的安全性存在疑虑,尤其是在COVID-19疫苗推广过程中,对长期效果的担忧、信息误导和信任危机均可能影响疫苗的接受度。尽管大量研究已证实mRNA疫苗的安全性和有效性,但虚假信息的传播和公众对科学的不信任,仍是亟待解决的社会挑战。
其次,监管审批的复杂性构成了重要障碍。如何在应对公共卫生危机时实现快速审批与收集长期安全性数据的平衡,需要监管机构审慎考量。建立透明高效的监管审批流程,并确保持续的上市后监测,对于维护公众信任至关重要。
再者,伦理考量同样不容忽视。基因技术应用的社会接受度、尤其是在全球疫苗分配不均背景下的公平分配问题,是重要的伦理困境。确保全球范围内,特别是发展中国家能够获得可负担的mRNA疫苗,以避免出现“疫苗鸿沟”,是应对全球健康危机的关键伦理要求。
为有效应对这些挑战,政策制定者和社会各界需采取多方面措施。首先,加强有效的风险沟通和透明的监管流程至关重要。政府、科研机构和医疗专业人员应加强科学沟通,透明地提供疫苗信息,并积极打击虚假信息,以建立公众信任。透明地沟通疫苗的安全性、有效性以及潜在的罕见副作用,对于提高公众接受度具有决定性作用。其次,公平的全球分配机制是促进疫苗接种的关键。这需要国际合作和政策制定者共同努力,确保疫苗的全球可及性和公平性。在伦理方面,需要制定明确的指导方针,确保疫苗的公平可及性,并解决与基因技术相关的潜在社会担忧。
最后,多学科合作在解决这些挑战中具有必要性。科学界、政府、社会组织应紧密协作,通过科学教育和公众参与来提高疫苗素养。加强公共卫生教育和风险沟通,以提高公众对mRNA疫苗的科学认知和信任,是促进疫苗接种的长期策略。
4.4 未来前沿方向与创新机遇
mRNA疫苗平台在应对新发传染病和复杂疾病方面展现出巨大的潜力,其未来发展方向充满创新机遇,尤其体现在技术融合、疫苗设计优化、新型递送系统以及全球可及性提升等多个维度。
人工智能(AI)和机器学习(ML)将在加速疫苗开发进程中发挥核心作用。AI辅助设计能够大幅提升抗原筛选、表位预测和疫苗设计的效率与精准度。通过大数据分析和机器学习,AI可以预测最优的mRNA序列和修饰方案,从而优化翻译效率和免疫原性,实现疫苗设计的智能化和快速迭代。
多靶点疫苗的开发是应对病原体变异和复杂感染的重要趋势。此类疫苗旨在针对多种病原体或同一病原体的不同变种,例如通用流感疫苗、泛冠状病毒疫苗,以及能够同时预防多种感染或治疗复杂疾病(如癌症)的多抗原疫苗。结合新型佐剂的开发,可以进一步增强免疫应答的强度和广度,特别是对于难以诱导免疫的病原体或肿瘤抗原,从而实现更强效、更持久的保护,甚至诱导细胞免疫以对抗细胞内病原体或癌症。
在新型mRNA形式方面,自扩增mRNA(saRNA)和环状mRNA(circRNA)的应用展现出巨大潜力。saRNA因其自我复制能力,有望实现更低的疫苗剂量和更长的免疫保护期。而circRNA则因其稳定的环状结构,可能具有更高的稳定性和更持续的蛋白质表达,为新型mRNA疫苗的开发提供了新方向,从而延长抗原表达时间并增强免疫记忆。这些新型mRNA形式有望大幅降低所需剂量并延长免疫保护期,从而降低生产成本,提高疫苗的可及性。
此外,新型递送系统和制剂的改进,如冻干制剂,将降低对冷链的要求,提高mRNA疫苗的稳定性和靶向性,从而增强全球可及性和公平性。mRNA平台在非传染病领域的深远应用前景广阔,包括个体化癌症疫苗、自身免疫病的精确治疗、罕见遗传病的基因纠正、以及再生医学和细胞疗法中的应用,将为多种未满足的医疗需求提供革命性解决方案,实现更精准和个性化的治疗。
综上所述,未来的研究应聚焦于以下几个关键方向,以期在提升疫苗效力、安全性、可及性和响应速度方面实现突破:一是跨模态递送系统与智能响应性载体的开发;二是多组学驱动的精准抗原预测与疫苗设计;三是“多抗原-多表位”的模块化与可编程疫苗的构建;四是宿主免疫微环境的精准调控与疫苗佐剂的革新;五是构建全球疫苗生产与分配的“分布式”模型,通过去中心化生产和分销,增加疫苗的全球可及性和公平分配,确保全球公共卫生安全;六是整合生物传感和快速诊断技术,形成“诊断-疫苗”闭环,从而更迅速有效地应对新发传染病挑战,并持续投资于研究以克服物流和社会障碍,最大限度地发挥mRNA疫苗的影响力,探索疫苗对新兴变异株的有效性,这对持续的公共卫生保护至关重要。
5. 结论:mRNA疫苗平台的变革性影响与未来研究蓝图
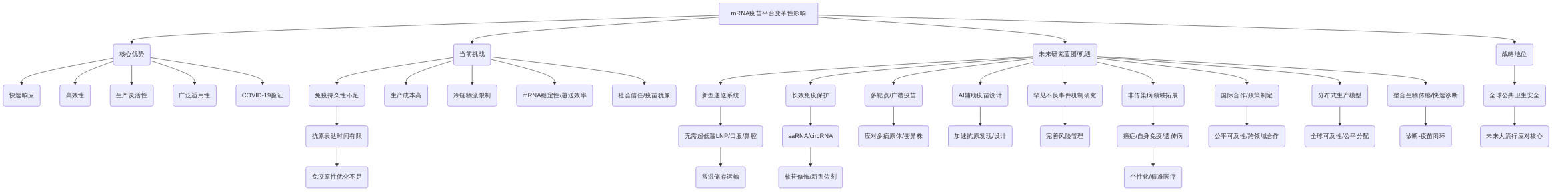
mRNA疫苗平台已展现出其变革性潜力,被广泛认为是新发传染病防控及更广泛疾病治疗领域的革命性工具。其核心优势在于快速响应能力、高效性、生产灵活性以及广泛的适用性,尤其在COVID-19大流行期间,这些优势得到了充分验证。
尽管mRNA疫苗平台取得了显著进展,但仍需克服一系列关键障碍。例如,免疫持久性不足是当前面临的主要挑战之一,其根本原因在于抗原表达时间有限和免疫原性优化不足。此外,生产成本、冷链物流、mRNA稳定性、递送效率以及社会信任和疫苗犹豫等问题,也限制了其在全球范围内的广泛应用和可及性。
为应对上述挑战,未来研究应聚焦于开发创新解决方案。针对免疫持久性问题,自扩增mRNA(saRNA)和环状RNA(circRNA)等新型mRNA分子设计与核苷修饰技术有望增强mRNA的翻译效率和稳定性,从而延长抗原表达时间,提升免疫原性。同时,引入新型佐剂以增强免疫反应也是重要的研究方向。
展望未来,mRNA平台在全球公共卫生安全和医疗进步中将占据关键战略地位。其快速响应能力使其成为应对未来大流行的核心工具。在个性化医疗领域,mRNA疫苗有望实现针对个体免疫特征或肿瘤新抗原的定制化疫苗,推动癌症免疫治疗、自身免疫病和遗传病等非传染病领域的精准治疗。此外,加强国际合作和政策制定,对于确保全球疫苗接种的公平可及性以及推动跨领域合作至关重要。
未来的研究蓝图应包括但不限于以下具体方向:
- 新型递送系统的开发与优化:着力于开发更安全、更具靶向性且无需超低温储存的递送系统,如冻干脂质纳米颗粒(LNP)、口服或鼻腔递送系统,以实现常温储存和运输,解决冷链物流难题。
- 长效免疫保护机制的探索:通过优化mRNA序列设计、改进递送系统和结合新型佐剂,延长抗原表达时间,提升免疫原性,实现更持久的免疫保护。
- 多靶点/广谱疫苗的设计与应用:开发能够同时靶向多种病原体或病毒变异株的疫苗,以应对复杂的感染情况和新兴变异株的挑战。
- 人工智能辅助疫苗设计:利用人工智能(AI)加速抗原发现和疫苗设计流程,提高疫苗开发的效率和精准度。
- 针对罕见不良事件的机制研究与风险管理:深入研究可能出现的罕见不良事件的潜在机制,并建立完善的风险管理体系,以确保疫苗的长期安全性和公众信任。
- 扩大mRNA疫苗在非传染病领域的应用:深化其在癌症免疫治疗、自身免疫病、遗传病以及蛋白质替代疗法等非传染病领域的应用,实现个体化和精准医疗的广泛普及。
通过持续的研发投入、技术创新、多学科交叉研究以及国际合作,mRNA疫苗平台有望在未来数十年内持续推动医学进步,为人类健康带来深远影响,成为全球疫苗接种工作的基石,并显著减轻全球传染病及其他疾病的负担。
References
mRNA vaccine platforms: Linking infectious disease prevention and cancer immunotherapy https://www.frontiersin.org/journals/bioengineering-and-biotechnology/articles/10.3389/fbioe.2025.1547025/abstract
What the Newest mRNA Vaccines Could Do Beyond COVID - News-Medical.net https://www.news-medical.net/health/What-the-Newest-mRNA-Vaccines-Could-Do-Beyond-COVID.aspx
Revolutionizing immunization: a comprehensive review of mRNA vaccine technology and applications - PubMed https://pubmed.ncbi.nlm.nih.gov/40075519/
Evaluating the safety and efficacy of novel mRNA vaccines for infectious diseases | Journal of Neonatal Surgery https://www.jneonatalsurg.com/index.php/jns/article/download/1519/1506/10602
mRNA technology: the key to pandemic preparedness ? - Alcimed https://www.alcimed.com/en/insights/technologie-arnm/
Enlisting the mRNA Vaccine Platform to Combat Parasitic Infections - PubMed https://pubmed.ncbi.nlm.nih.gov/31547081/
mRNA-based vaccines for rapid response to emerging infectious disease outbreaks | International Journal of Frontiers in Medicine and Surgery Research https://frontiersrj.com/journals/ijfmsr/content/mrna-based-vaccines-rapid-response-emerging-infectious-disease-outbreaks
mRNA Vaccines: Transforming Disease Prevention for the Modern Era - International Journal of Health Sciences and Research https://www.ijhsr.org/IJHSR\_Vol.14\_Issue.10\_Oct2024/IJHSR55.pdf
